网址:http://m.1010jiajiao.com/timu3_id_67471[举报]
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S
C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料
D.Cs和Ba分别位于第六周期IA和ⅡA族,碱性:CsOH >Ba(OH)2
查看习题详情和答案>>
A、B、C是短周期IA和ⅡA族元素的碳酸盐,它们的质量分别为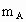 、
、 、
、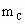 ,与足量盐酸完全反应,消耗盐酸的物质的量分别为
,与足量盐酸完全反应,消耗盐酸的物质的量分别为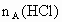 、
、 、
、 .
.
已知: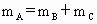 ,
,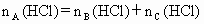 .请填空:
.请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:_______________.
(2)若以 、
、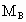 和
和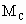 分别表示A、B、C的相对分子质量,试写出
分别表示A、B、C的相对分子质量,试写出 、
、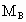 和
和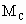 三者的相互关系式_______________.
三者的相互关系式_______________.
(3)A的正确选择有_______种,其化学式为:________
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是_______________,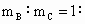 _________.(保留2位小数)
_________.(保留2位小数)
A、B、C是短周期IA和ⅡA族元素的碳酸盐,它们的质量分别为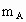 、
、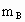 、
、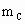 ,与足量盐酸完全反应,消耗盐酸的物质的量分别为
,与足量盐酸完全反应,消耗盐酸的物质的量分别为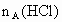 、
、 、
、 .
.
已知: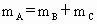 ,
,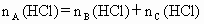 .请填空:
.请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:_______________.
(2)若以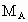 、
、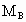 和
和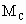 分别表示A、B、C的相对分子质量,试写出
分别表示A、B、C的相对分子质量,试写出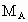 、
、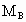 和
和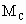 三者的相互关系式_______________.
三者的相互关系式_______________.
(3)A的正确选择有_______种,其化学式为:________
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是_______________,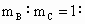 _________.(保留2位小数)
_________.(保留2位小数)
(13分)下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小题:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在以上表格中所有元素里基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,,则属于s区的元素有 种,属于d区的元素有 种。第二周期元素中除Ne外电负性由高到低的三种元素依次是 ,电离能由高到低的三种元素依次是 。
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
|
元素 |
Mn |
Fe |
|
|
电离能 ( kJ·mol-1) |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
回答下列问题:
Mn元素的电子排布式为____________________________________,
Fe2+的电子排布图为__________________________
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个 电子难。对此,你的解释是:_____________________________
【解析】(1)考查元素周期表的结构和原子核外电子的排布规律。根据构造原理可知4s轨道上只有1个电子的元素是K、Cr和 Cu。
(2)除ds区外,区的名称来自于构造原理最后填入电子的能级的符号,即s区包括第IA和ⅡA,共2列。p区包括第ⅢA到第 ⅦA以及0族,共6列。D区包括第3列到第10列,共8列。ds区包括第11和12列,共2列。非金属性越强,电负性越大,第一电离能也越大,非金属性是Cl>S>P,所以电负性是Cl>S>P。由于P原子的3p轨道属于半充满,属于第一电离能是Cl>P>S。
(3)根据构造原理可以写出锰元素的电子排布,即1s22s22p63s23p63d54s2,Fe2+的电子排布图为1s22s22p63s23p63d6。由于Mn2+的3d轨道属于半充满,比较稳定,所以再失去1个电子所需要的能量就高。而Fe2+的3d轨道上有6个电子,Fe3+的3d轨道上有5个电子,属于不充满比较稳定,因此3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。
查看习题详情和答案>>