摘要:10.设为阿伏加德罗常数的值.下列叙述正确的是w w w. k#s5 A.常温下.1L0.1mol/L的溶液中氮原子数为0.2 B.1mol羟基中电子数为10 C.在反应KI+6HI=KI+3I2+3H2O中.每生成3mol转移的电子数为6 D.常温常压下W W W K S 5 U . C O M .22.4L乙烯中键数为4 解析:本题主要是以阿伏伽德罗常数为载体考查如下知识点①考查22.4L/mol的正确使用,②考查在氧化还原反应中得失电子数的计算等内容.无论NH4+水解与否.根据元素守恒.A正确, 1mol羟基中有9个电子.因此选项B 错误,在该反应中.6mol HI参与反应被氧化的是5ml.因此每生成3mol,转移5个电子.所以选项C错误,D项.常温常压下.气体摩尔体积不是22.4L/mol.综上分析得知.本题选A项. 答案:A w w w. k#s5
网址:http://m.1010jiajiao.com/timu3_id_67088[举报]
设 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温下, 的
的 溶液中氮原子数为0.2
溶液中氮原子数为0.2
B.1mol羟基中电子数为10
C.在反应中,每生成3mol 转移的电子数为6
转移的电子数为6
D.常温常压下,22.4L乙烯中 键数为4
键数为4
查看习题详情和答案>>
 为阿伏加德罗常数的值,下列叙述正确的是(
)
为阿伏加德罗常数的值,下列叙述正确的是(
) ·
·
 氟化氢中含有氟原子的数目为
氟化氢中含有氟原子的数目为


 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
 的分子数为
的分子数为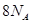
 的醋酸溶液中,离子和分子的总数为
的醋酸溶液中,离子和分子的总数为
