网址:http://m.1010jiajiao.com/timu3_id_66013[举报]
CO是重要的化工原料,应用十分广泛。
(1)已知: C(s)+O2(g) CO2(g) ![]() kJ·mol-1
kJ·mol-1
C(a)+H2O(g) CO(g)+H2(g) ![]() kJ·mol-1
kJ·mol-1
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g)的![]() 。
。
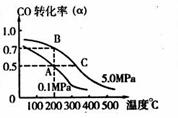
(2)在10L密闭容器中充有10 molCO 与20molH2,
在催化剂作用下反应生成甲醇:
CO(g)+2H2(g) ![]() CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率(![]() )
)
与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,
则在A点该温度下的平衡常数K= 。
②若A、C两点都表示达到平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
(3)室温下,向一定量的稀氨水中逐滴加入浓度相同的稀盐酸。
①当溶液中离子浓度关系满足c(NH4+)<(Cl-)时,则反应的情况可能为 (填写序号字母)
A.盐酸不足,氨水剩余,溶液显碱性
B.氨水与盐酸恰好完全反应
C.盐酸过量
②当溶液的pH为7时,溶液中各离子浓度的大小关系为 。
③实验过程中,氨水中的溶2O的电子离程度先 后 (填“增大”、“减小”或“不变”)。
查看习题详情和答案>>2I-+2Fe3+ƒ2Fe2++I2(aq)
(1)该反应的平衡常数K的表达式为:K=________,当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡________移动(填“向右”、“向左”或“不”)。
(2)上述反应的正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)×cn(Fe3+)(k为常数)
浓度与反应速率的关系
c(I-)/mol×L-1 c(Fe3+)/mol×L-1 v/
mol×L-1
(1) 0.20 0.80 0.032k
(2) 0.60 0.40 0.144k
(3) 0.80 0.20 0.128k
通过所给的数据计算可知:
在v=kcm(I-)×cn(Fe3+)中,m、n的值为( )
A.m=1,n=1 B.m=1,n=2
C.m=2,n=1 D.m=2,n=2
I-浓度对反应速率的影响________Fe3+浓度对反应速率的影响(填“大于”、“小于”或“等于”)。
查看习题详情和答案>>
2KNO3+S+3C
 K2S+N2↑+3CO2↑,下列有关叙述中正确的是
K2S+N2↑+3CO2↑,下列有关叙述中正确的是 B、在黑火药爆炸的反应中,当有1molKNO3反应时,转移电子的总物质的量为5mol
C、三种反应物可以形成三种不同类型的晶体,三种生成物可以形成两种不同类型的晶体
D、在K2S晶体中,K+与S2-电子层结构相同,但K+半径大于S2-半径
|
某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示.下列说法正确的是
提示:BaSO4(s) | |
| [ ] | |
A. |
加入Na2SO4可以使溶液由a点变到b点 |
B. |
通过蒸发可以使溶液由d点变到c点 |
C. |
a点对应的K sp大于c点对应的Ksp |
D. |
d点无BaSO4沉淀生成 |
|
NA为阿伏加德罗常数,下列各项叙述中正确的有 ①0.2 mol H2O2完全分解转移的电子数为0.4NA ②25℃、101 k Pa下,16 g O3和O2混合气体中含有的氧原子数为NA ③0.1 mol FeCl3滴入沸水形成的胶体粒子的数目为0.1NA ④1 mol N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2NA | |
| [ ] | |
A. |
①②③ |
B. |
①②④ |
C. |
①②③④ |
D. |
②④ |
