摘要:准确称取0.585gNaCl于100mL烧杯中.用蒸馏水溶解后.定量转移入100mL容量瓶中.加水稀释至刻度.摇匀. 取配好的NaC1溶液25.00mL3份.分别置于锥形瓶中.加25mL水.1mL5%K2CrO4溶液.在不断摇动下用AgNO3溶液滴定.至溶液呈砖红色(2Ag++CrO42-=Ag2CrO4↓).实验测得三次所耗硝酸银溶液体积的平均值为26.32mL.
网址:http://m.1010jiajiao.com/timu3_id_65999[举报]
某实验小组的同学测定碳酸钡样品中所含碳酸钡的质量分数,有如下操作:
Ⅰ.准确称取0.250g样品,磨碎后加入少量蒸馏水;
Ⅱ.加入35.00mL0.1mol?L-1 的盐酸,充分反应后样品溶解;
Ⅲ.以酚酞为指示剂,用0.1mol?L-1 NaOH溶液滴定至终点;
Ⅳ.重复上述操作3次.
①第Ⅰ步磨碎样品后加入少量蒸馏水及第Ⅱ步溶解样品均在
②判断滴定达到终点的现象为
③重复上述操作(均加入35.00mL0.1mol?L-1 的盐酸),滴定时平均耗用0.100mol?L-1 的NaOH溶液15.00mL,通过计算,样品中BaCO3的质量分数为
④下列操作使所测样品中碳酸钡的质量分数偏大的是
A.滴定前滴定管尖嘴部分有气泡,滴定后无气泡
B.向样品中加盐酸时,有少量盐酸溅出
C.滴定时,有少量NaOH溶液滴到瓶外壁上
D.读滴定管开始时仰视,终点读数时俯视.
查看习题详情和答案>>
Ⅰ.准确称取0.250g样品,磨碎后加入少量蒸馏水;
Ⅱ.加入35.00mL0.1mol?L-1 的盐酸,充分反应后样品溶解;
Ⅲ.以酚酞为指示剂,用0.1mol?L-1 NaOH溶液滴定至终点;
Ⅳ.重复上述操作3次.
①第Ⅰ步磨碎样品后加入少量蒸馏水及第Ⅱ步溶解样品均在
锥形瓶、
锥形瓶、
(填仪器名称)中进行;第Ⅱ步操作中加入35.00mL0.100mol?L-1 的盐酸所使用的仪器是酸式滴定管
酸式滴定管
.②判断滴定达到终点的现象为
最后一滴滴入后,溶液由无色变为浅红色,且30s内不变色
最后一滴滴入后,溶液由无色变为浅红色,且30s内不变色
.③重复上述操作(均加入35.00mL0.1mol?L-1 的盐酸),滴定时平均耗用0.100mol?L-1 的NaOH溶液15.00mL,通过计算,样品中BaCO3的质量分数为
78.8%
78.8%
.④下列操作使所测样品中碳酸钡的质量分数偏大的是
BD
BD
.A.滴定前滴定管尖嘴部分有气泡,滴定后无气泡
B.向样品中加盐酸时,有少量盐酸溅出
C.滴定时,有少量NaOH溶液滴到瓶外壁上
D.读滴定管开始时仰视,终点读数时俯视.
电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成.下列装置是用燃烧法确定有机物分子式常用的装置.
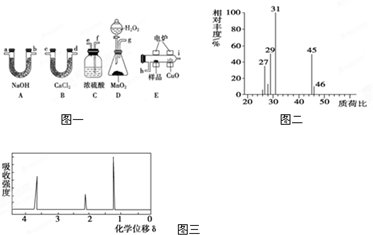
(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是
(2)C装置中浓硫酸的作用是
(3)D装置中MnO2的作用是
(4)燃烧管中CuO的作用是
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为
(6)用质谱仪测定其相对分子质量,得如图一所示的质谱图,则该有机物的相对分子质量为
(7)能否根据A的实验式确定A的分子式
(8)该物质的核磁共振氢谱如图二所示,则其结构简式为
查看习题详情和答案>>

(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是
g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a)
g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a)
.(2)C装置中浓硫酸的作用是
吸收水分、干燥氧气
吸收水分、干燥氧气
.(3)D装置中MnO2的作用是
作催化剂、加快产生O2的速率
作催化剂、加快产生O2的速率
.(4)燃烧管中CuO的作用是
使有机物更充分氧化为CO2、H2O;
使有机物更充分氧化为CO2、H2O;
.(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为
C2H6O
C2H6O
.(6)用质谱仪测定其相对分子质量,得如图一所示的质谱图,则该有机物的相对分子质量为
46
46
.(7)能否根据A的实验式确定A的分子式
能
能
(填“能”或“不能”),若能,则A的分子式是C2H6O
C2H6O
(若不能,则此空不填).(8)该物质的核磁共振氢谱如图二所示,则其结构简式为
CH3CH2OH
CH3CH2OH
.电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下列装置是用燃烧法确定有机物分子式常用的装置(E中电炉省去).
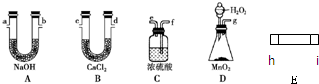
(1)产生的氧气按从左到右的流向,所选装置各导管的连接顺序是
(2)C装置中浓H2SO4的作用是
(3)D装置中MnO2的作用是
(4)E燃烧管中CuO的作用是
(5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为
(6)要确立该有机物的分子式,还要知道
查看习题详情和答案>>

(1)产生的氧气按从左到右的流向,所选装置各导管的连接顺序是
g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a)
g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a)
.(2)C装置中浓H2SO4的作用是
吸收水分、干燥氧气
吸收水分、干燥氧气
.(3)D装置中MnO2的作用是
作催化剂、加快产生O2的速率
作催化剂、加快产生O2的速率
.(4)E燃烧管中CuO的作用是
使有机物充分氧化生成CO2和H2O
使有机物充分氧化生成CO2和H2O
.(5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为
CH2O
CH2O
.(6)要确立该有机物的分子式,还要知道
有机物的相对分子质量
有机物的相对分子质量
.通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成.如图所示的是用燃烧法确定有机物物分子式的常用装置.

(1)现准确称取0.44g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88g,B管增重0.36g.请回答:
(1)按上述所给的测量信息,装置的连接顺序应是:D→
(2)A、B管内均盛有有固态试剂,A管的作用是
(3)E中应盛装什么试剂:
(4)如果把CuO网去掉,A管重量将
(5)请改进这套装置的一个不足之处
(6)该有机物的实验式为
(7)要确定该有机物的分子式,还必须知道的数据是
①消耗液体E的质量 ②样品的摩尔质量 ③CuO固体减少的质量 ④C装置增加的质量 ⑤燃烧消耗O2的物质的量.
查看习题详情和答案>>

(1)现准确称取0.44g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88g,B管增重0.36g.请回答:
(1)按上述所给的测量信息,装置的连接顺序应是:D→
C
C
F→B
B
→A
A
;(2)A、B管内均盛有有固态试剂,A管的作用是
吸收生成的二氧化碳
吸收生成的二氧化碳
; (3)E中应盛装什么试剂:
H2O2
H2O2
;(4)如果把CuO网去掉,A管重量将
减小
减小
;(填“增大”、“减小”、或“不变”)(5)请改进这套装置的一个不足之处
在A装置后连接一个重要碱石灰的干燥管
在A装置后连接一个重要碱石灰的干燥管
;(6)该有机物的实验式为
C2H4O
C2H4O
;(7)要确定该有机物的分子式,还必须知道的数据是
②
②
.(填编号)①消耗液体E的质量 ②样品的摩尔质量 ③CuO固体减少的质量 ④C装置增加的质量 ⑤燃烧消耗O2的物质的量.
水泥是一种重要的建筑材料,水泥的强度是评价水泥质量的重要指标,它与水泥中CaO的含量有着良好的相关性,因此在特殊情况下可以通过测定其中Ca0的含量预测水泥的强度.为测量某品牌水泥中氧化钙的含量,进行如下实验:
步骤1:熔样:准确称取0.3000g试样置于坩埚中,高温灼烧5分钟后,冷却并研碎,加入2.000g无水碳酸钠混匀后,再高温灼烧10分钟.
步骤2:酸溶:取冷却后的烧结块,加入40mL水后,再加入l0mL稀盐酸和3滴稀硝酸.
步骤3:除杂:在酸溶后所得溶液中慢慢滴加稀氨水使其中的Fe3+、Al3+转化为沉淀,过滤.
步骤4:沉淀:在滤液中加入草酸铵溶液,加热煮沸后,边搅拌边滴加氨水至弱碱性,静置.
步骤5:溶解:将生成的草酸钙( CaC2O4)沉淀加入到稀硫酸中,加热并搅拌使其完全溶解.
步骤6:滴定:用0.1000mol?L-1的KMnO4溶液进行滴定至微红色出现并保持30s不消失,共用去KMnO4溶液13.000mL.反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+5CO2↑+8H2O
(1)写出步骤3中Al3+转化为沉淀的离子方程式:
(2)已知室温下Al(OH)3的Ksp=1.0×10-33,欲使溶液中c(Al3+)≤l.0xl0-6mol?L-1,pH≥
(3)通过计算确定该试样中氧化钙的质量分数(写出计算过程).
查看习题详情和答案>>
步骤1:熔样:准确称取0.3000g试样置于坩埚中,高温灼烧5分钟后,冷却并研碎,加入2.000g无水碳酸钠混匀后,再高温灼烧10分钟.
步骤2:酸溶:取冷却后的烧结块,加入40mL水后,再加入l0mL稀盐酸和3滴稀硝酸.
步骤3:除杂:在酸溶后所得溶液中慢慢滴加稀氨水使其中的Fe3+、Al3+转化为沉淀,过滤.
步骤4:沉淀:在滤液中加入草酸铵溶液,加热煮沸后,边搅拌边滴加氨水至弱碱性,静置.
步骤5:溶解:将生成的草酸钙( CaC2O4)沉淀加入到稀硫酸中,加热并搅拌使其完全溶解.
步骤6:滴定:用0.1000mol?L-1的KMnO4溶液进行滴定至微红色出现并保持30s不消失,共用去KMnO4溶液13.000mL.反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+5CO2↑+8H2O
(1)写出步骤3中Al3+转化为沉淀的离子方程式:
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
;(2)已知室温下Al(OH)3的Ksp=1.0×10-33,欲使溶液中c(Al3+)≤l.0xl0-6mol?L-1,pH≥
5
5
;(3)通过计算确定该试样中氧化钙的质量分数(写出计算过程).