摘要:(一)“基 . “根 的区别 42.等物质的量的甲基(-CH3)和羟基(-OH)所含电子数相等( ) 43.17g羟基中所含电子数为10NA( ) 44.在1mol的CH5+中所含的电子数为10NA( ) 45.常温常压下.1mol碳烯(:CH2)所含的电子数为8NA( ) 46.16g CH4与18 g NH4+ 所含质子数相等( )
网址:http://m.1010jiajiao.com/timu3_id_65881[举报]
选用最佳试剂完成下列实验.
(1)除去乙烷中混有的少量乙烯,所用的试剂是
(2)除去混在硝基苯中的硝酸,所用的试剂是
(3)除去混在溴苯中的溴,所用的试剂是
(4)区别苯与甲苯,所用的试剂是
查看习题详情和答案>>
(1)除去乙烷中混有的少量乙烯,所用的试剂是
溴水
溴水
;(2)除去混在硝基苯中的硝酸,所用的试剂是
NaOH溶液
NaOH溶液
;(3)除去混在溴苯中的溴,所用的试剂是
NaOH溶液
NaOH溶液
;(4)区别苯与甲苯,所用的试剂是
酸性KMnO4溶液
酸性KMnO4溶液
.(2012?济南二模)[化学-物质结构与性质]
氨和水都是常用的试剂.请回答下列问题:
(1)氮元素基态原子的核外电子中,未成对电子数与成对电子数之比为
(2)NH3分子可结合一个H+形成铵根离子(N
).
①NH3分子中N原子的杂化类型是
②NH3分子与H+结合的过程中未发生改变的是
a.微粒的空间构型 b.N原子的杂化类型 c.H-N-H的键角
(3)将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液.该过程中微粒的变化是:[Cu(H2O)6]2+→Cu(OH)2→[Cu(NH3)4]2+.[Cu(H2O)6]2+和[Cu(NH3)4]2+中共同含有的化学键类型是
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,则冰晶体中氢键的“键能”是
查看习题详情和答案>>
氨和水都是常用的试剂.请回答下列问题:
(1)氮元素基态原子的核外电子中,未成对电子数与成对电子数之比为
3:4
3:4
.(2)NH3分子可结合一个H+形成铵根离子(N
| H | + 4 |
①NH3分子中N原子的杂化类型是
sp3
sp3
.②NH3分子与H+结合的过程中未发生改变的是
b
b
.(填序号)a.微粒的空间构型 b.N原子的杂化类型 c.H-N-H的键角
(3)将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液.该过程中微粒的变化是:[Cu(H2O)6]2+→Cu(OH)2→[Cu(NH3)4]2+.[Cu(H2O)6]2+和[Cu(NH3)4]2+中共同含有的化学键类型是
共价键、配位键
共价键、配位键
.(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,则冰晶体中氢键的“键能”是
20
20
kJ?mol-1(已知冰的升华热是51kJ?mol-1,水分子间范德华力的能量为11kJ?mol-1);水变成冰晶体时,密度减小的主要原因是氢键具有方向性,水结冰时分子间距增大,晶体内部有很大的间隙
氢键具有方向性,水结冰时分子间距增大,晶体内部有很大的间隙
. (2010?江苏一模)过渡元素在生活、生产和科技等方面有广泛的用途.
(2010?江苏一模)过渡元素在生活、生产和科技等方面有广泛的用途.(1)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子).则图示铁颗粒表面上氮原子与铁原子的个
数比为
1:2
1:2
.(2)现代污水处理工艺中常利用聚合铁{简称PFS,化学式为:[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子.下列说法中不正确的是
D
D
.(填序号)A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| 元素 | Mn | Fe | |
| 电离能 (kJ?mol-1) |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |

①该化合物中存在的化学键类型有
离子键、共价键和配位键
离子键、共价键和配位键
.②该化合物中一个Cr的配位数为
6
6
.③甲基丙烯酸分子中C原子的杂化方式有
sp3、sp2
sp3、sp2
.④等电子体是具有相同的价电子数和原子数的分子或离子,与H2O分子互为等电子体的微粒是
H2S、NH2-
H2S、NH2-
.(填一种即可)⑤与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是
K Cu
K Cu
.(填元素符号)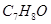 且分子中有苯环的有机物共有4种
且分子中有苯环的有机物共有4种