网址:http://m.1010jiajiao.com/timu3_id_65655[举报]
B.溶液中阳离子所带的正电荷总数一定等于阴离子所带的负电荷总数
C.溶液中除阴、阳离子外,不会再有其他粒子
D.电解质溶液的导电性强弱与离子所带电荷数成正比,与溶液浓度无关
B.“能够导电”是指该物质本身能够导电,而不是它发生反应后的生成物能导电
C.“化合物”指明了该物质不能是单质,更不能是混合物
D.像硫酸钡、碳酸钙这样难溶的化合物就不可能是电解质了
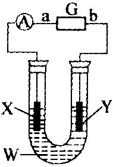
(1)利用电解原理在如图装置中完成粗铜提纯,则电解质溶液W为_________,阳极材料X为_________;
(2)已知直流电源G为高铁电池,高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应式为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH则b电极反应式为_________;放电时每转移3 mol电子,正极有_________mol_________被还原;
3Zn(OH)2+2Fe(OH)3+4KOH则b电极反应式为_________;放电时每转移3 mol电子,正极有_________mol_________被还原;
(3)若X、X为石墨板,W为CuSO4溶液,电解一段时间后,向电解后的残留液中加入足量铁粉充分反应,过滤、蒸干、称重,发现铁粉增重3.2g;洗净、烘干、称重,发现Y板增重1.6 g。则从理论上讲,电解过程中高铁电池的锌电极质量减少_________g;电解后溶液pH为_________;原CuSO4溶液的物质的量浓度为_________mol·L-1。
查看习题详情和答案>> 电解原理在化学工业上有着广泛的应用,按下图所示所示装置进行电解实验。A、B、C、D均为惰性电极,开始电解前在甲装置的A、B极两侧各滴入酚酞试液。
电解原理在化学工业上有着广泛的应用,按下图所示所示装置进行电解实验。A、B、C、D均为惰性电极,开始电解前在甲装置的A、B极两侧各滴入酚酞试液。
工作一段时间后:
(1)A极附近可观察到的现象是_____________________
_______________________________________________;
检验B电极上反应产物的通常方法是_____________;
甲电池中电解反应的离子方程式是 _______________________________________;
溶液中还可能存在的离子反应方程式是 ____________________________________。
(2)甲槽溶液的pH________________________(填“增大”、“不变”或 “减小”,下同);乙槽溶液的pH_______________。当A极上收集到22.4L气体(标准状况)时,乙装置的C极上可得到____________g金属单质。
利用A、D两极上析出的物质制成的燃料电池,是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答(3)~(6):
(3)氢氧燃料电池的能量转化主要形式是 ,
 在导线中电子流动方向为 (用a、b 表示)。
在导线中电子流动方向为 (用a、b 表示)。
(4)负极反应式为 ____________。
(5)电极表面镀铂粉的原因为 __________
(6)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2=2LiH Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②先用锂吸收224L(标准状况)H2,将生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
查看习题详情和答案>>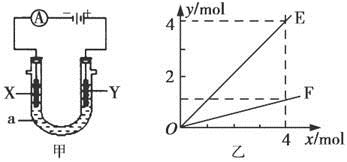
| A.若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 |
| B.按图甲装置用惰性电极电解AgNO3溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 |
| C.按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5 mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol |
| D.若X、Y为铂电极,a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol·L-1 |