摘要:6.下列叙述中不正确的是( ) A.一定浓度的醋酸钠溶液可使酚酞试液变红.其原因是发生了如下反应: CH3COO-+H2OCH3COOH+OH- 使得溶液中的c(OH-) > c(H+) B.在0.1 mol/L Na2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-) C.在0.1 mol/L NH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-) D.将0.2 mol/L 的盐酸与0.1 mol/L 的NaAlO2溶液等体积混合.其溶液中离子浓度由小到大的顺序为:c(OH-)<c(H+)<c(Al3+)<c(Na+)<c(Cl-) 7.合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应: N2(g)+3H2(g)2NH3(g).△H<0. 在673K.30Mpa下n(NH3)和n(H2) 随时间变化的关系如图所示.下列叙述 正确的是( ) A.点c处反应达到平衡 B.点a的正反应速率比点b的大 C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 D.其它条件不变.773K下反应至t1时刻.n(H2)比图中d点的值小
网址:http://m.1010jiajiao.com/timu3_id_64922[举报]
下列叙述中不正确的是
[ ]
A.一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO-+H2O CH3COOH+OH- ,使得溶液中的c(OH-)>c(H+)
CH3COOH+OH- ,使得溶液中的c(OH-)>c(H+)
B.在常温下,10 mL 0.02 mol/L HCl溶液与10 mL 0.02 mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1 mol/L NH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-)
D.将0.2 mol/L的盐酸与0.1 mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+) <c(Na+) <c(Cl-)
查看习题详情和答案>>
 CH3COOH+OH- ,使得溶液中的c(OH-)>c(H+)
CH3COOH+OH- ,使得溶液中的c(OH-)>c(H+) B.在常温下,10 mL 0.02 mol/L HCl溶液与10 mL 0.02 mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1 mol/L NH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-)
D.将0.2 mol/L的盐酸与0.1 mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+) <c(Na+) <c(Cl-)
下列叙述中不正确的是 ( )
A.一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是发生了如下反应:
CH3COO-+H2O ![]() CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
CH3COOH+OH-使得溶液中的c(OH-)>c(H+)
B.在0.1mol/LNa2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO2-3)+c(HCO3-)
C.在0.1mol/LNH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-)
D.将0.2mol/L的盐酸与0.1mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(H+)<c(Al3+)<c(Na+)<c(Cl-)
查看习题详情和答案>>|
下列叙述中不正确的是 | |
| [ ] | |
A. |
一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是发生了如下反应: CH3COO-+H2O |
B. |
在0.1 mol/L Na2CO3溶液中:2c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-) |
C. |
在0.1 mol/L NH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
D. |
将0.2 mol/L的盐酸与0.1 mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(H+)<c(Al3+)<c(Na+)<c(Cl-) |
 CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)
CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)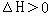 平衡后,升高温度,c(Z)增大
平衡后,升高温度,c(Z)增大 CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)
CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) 平衡后,升高温度,c(Z)增大
平衡后,升高温度,c(Z)增大