摘要:30.将30g铜.银合金在80mL13.5mol/L的浓硝酸中完全溶解.产生6.72L(STP)NO和NO2的混合气体,反应后溶液仍为80mL,pH=0.求: (1)若浓硝酸中HNO3的质量分数为69%.则浓硝酸的密度为 g/cm3, (2)被还原的硝酸 mol; (3) 合金中银的质量分数为 %.
网址:http://m.1010jiajiao.com/timu3_id_64512[举报]
30 g铜、银合金与80 mL 13.5 mol·L-1的HNO3溶液反应。合金全部溶解,放出气体6.72 L(标准状况下),反应后溶液的pH=0(设反应前后溶液体积不变)
(1)计算HNO3被还原的物质的量;
(2)计算合金中银的质量分数。
查看习题详情和答案>>
能够实现反应Cu+2H2O====Cu(OH)2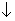 +H2
+H2 的是( )
的是( )
A.铜银合金在潮湿空气中发生电化学腐蚀
B.用铜片作阴极、石墨作阳极,电解饱和氯化钠溶液
C.用铜片作阳极、石墨作阴极,电解饱和氯化钠溶液
D.铜片作原电池的负极,石墨作原电池的正极,氯化钠溶液作电解质溶液
查看习题详情和答案>>14g铜、银合金与足量的某浓度的硝酸反应,将放出气体与1.12L(标准 壮况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量是
A.9.6g B.6.4g C.3.2g D.1.6g
查看习题详情和答案>>