摘要:(1)适当提高反应温度.增加浸出时间 3 Al(OH)3 (3)Na2SO4 (4)①在某一温度时.NaCl最先达到饱和析出,Mg(ClO3)2的溶解度随温度变化的最大, NaCl 的溶解度与其他物质的溶解度有一定的差别. ② 降温前.溶液中NaCl已达饱和,降低过程中.NaCl溶解度会降低 .会少量析出.重结晶. [考点分析]对常见金属元素及其化合物主要性质的掌握.以及对离子反应实质的认识.考查考生运用基础知识解决简单化学问题的能力.以及对图表观察分析能力.
网址:http://m.1010jiajiao.com/timu3_id_64385[举报]
(2013?江苏二模)氧化铜矿石含有CuO和Cu2(OH)2CO3,还含有Fe2O3、FeO和SiO2等.铜、铁是畜禽所必需的微量元素.某饲料厂联合生产硫酸铜和硫酸亚铁工艺流程如下:
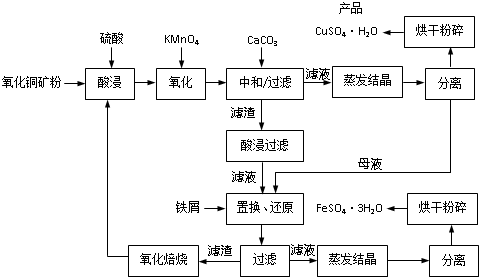
(1)氧化铜矿石粉碎的目的是
(2)写出“酸浸”中Cu2(OH)2CO3发生反应的离子方程式
(3)“中和/过滤”中加入CaCO3的目的是
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有
(5)加入铁屑的作用是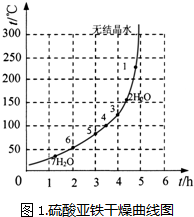
(6)表2和图1为“烘干粉碎”的试验结果.
表2.硫酸铜晶体(CuSO4?5H2O)干燥试验表
表2中,m为CuSO4?5H2O晶体的质量,x为干燥后所得晶体中结晶水的个数.据此可确定由CuSO4?5H2O和FeSO4?7H2O脱水得流程中所示产品的适宜工艺条件分别为
查看习题详情和答案>>

(1)氧化铜矿石粉碎的目的是
增大接触面积,加快化学反应速率
增大接触面积,加快化学反应速率
.(2)写出“酸浸”中Cu2(OH)2CO3发生反应的离子方程式
Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑
Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑
.(3)“中和/过滤”中加入CaCO3的目的是
适当降低溶液的酸性,使Fe3+水解成沉淀而除出
适当降低溶液的酸性,使Fe3+水解成沉淀而除出
.(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有
烧杯、玻璃棒、漏斗
烧杯、玻璃棒、漏斗
.(5)加入铁屑的作用是
使母液中Fe3+转化为Fe2+、除去Cu2+
使母液中Fe3+转化为Fe2+、除去Cu2+
、提高硫酸亚铁晶体的纯度
提高硫酸亚铁晶体的纯度
.
(6)表2和图1为“烘干粉碎”的试验结果.
表2.硫酸铜晶体(CuSO4?5H2O)干燥试验表
| 序号 | t/h | t/℃ | m/g | x |
| 1 | 3 | 80 | 5 | 4 |
| 2 | 3 | 160 | 10 | 1 |
| 3 | 4 | 160 | 10 | 0.8 |
| 4 | 4 | 160 | 5 | 0 |
| 5 | 5 | 80 | 5 | 3 |
| 6 | 5 | 160 | 15 | 1 |
160℃、3h
160℃、3h
,125(±5)℃、4.0h
125(±5)℃、4.0h
(分别指出两条件的温度和时间).(2012?长宁区一模)Ⅰ.工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅.
(1)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用.精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是
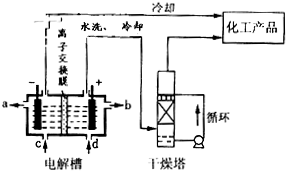
(2)如图是离子交换膜(允许钠离子通过,不允许氢氧根与氯离子通过)法电解饱和食盐水示意图,电解槽阳极产生的气体是
Ⅱ.多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注.
(1)SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为
(2)SiCl4可转化为SiHCl3而循环使用.一定条件下,在20L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为
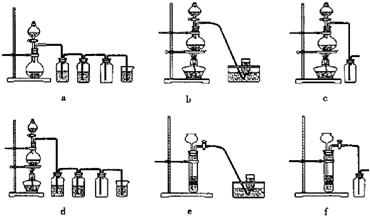
(3)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4→ZnSO4+H2↑;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置
可选用制备气体的装置:
(4)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
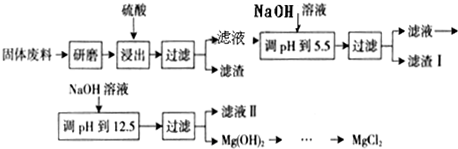
Ⅲ.部分阳离子以氢氧化物形式完全沉淀时溶液的pH见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(2)滤渣I的主要成分是
Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3→Mg(ClO3)2+2NaCl
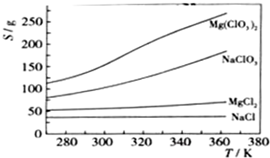
已知四种化合物的溶解度(S)随温度(T)变化曲线如图所示:
(3)将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因:
(4)按题(3)中条件进行制备实验.在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
查看习题详情和答案>>
(1)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用.精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是
③①②
③①②
(填序号)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为③
③
.(填序号)(①饱和Na2CO3溶液 ②饱和K2CO3溶液 ③75%乙醇 ④四氯化碳)(2)如图是离子交换膜(允许钠离子通过,不允许氢氧根与氯离子通过)法电解饱和食盐水示意图,电解槽阳极产生的气体是
氯气
氯气
;NaOH溶液的出口为a
a
(填字母);精制饱和食盐水的进口为d
d
(填字母);干燥塔中应使用的液体是浓硫酸
浓硫酸
.
Ⅱ.多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注.
(1)SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为
SiCl4+2H2+O2
SiO2+4HCl
| ||
SiCl4+2H2+O2
SiO2+4HCl
.
| ||
(2)SiCl4可转化为SiHCl3而循环使用.一定条件下,在20L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为
0.351
0.351
kg.(3)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4→ZnSO4+H2↑;MnO2+4HCl(浓)
| △ |
据此,从下列所给仪器装置中选择制备并收集H2的装置
e
e
(填代号)和制备并收集干燥、纯净Cl2的装置d
d
(填代号).可选用制备气体的装置:

(4)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气
134.4
134.4
m3(标准状况).(忽略可能存在的其他反应)某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
适当提高反应温度、增加浸出时间
适当提高反应温度、增加浸出时间
(要求写出两条).(2)滤渣I的主要成分是
Fe(OH)3、Al(OH)3
Fe(OH)3、Al(OH)3
.Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3→Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如图所示:

(3)将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因:
在某一温度时,NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化的最大,NaCl的溶解度与其他物质的溶解度有一定的差别;
在某一温度时,NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化的最大,NaCl的溶解度与其他物质的溶解度有一定的差别;
.(4)按题(3)中条件进行制备实验.在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
降温前,溶液中NaCl已达饱和,降低过程中,NaCl溶解度会降低,会少量析出;
降温前,溶液中NaCl已达饱和,降低过程中,NaCl溶解度会降低,会少量析出;
.除去产品中该杂质的方法是:重结晶
重结晶
.