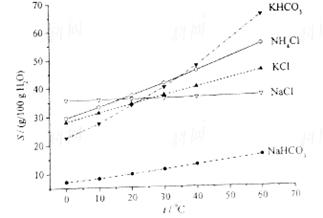
摘要:实验室以氯化钾和硝酸钠为原料制备硝酸钾的实验流程如下: 硝酸钾等四种物质的溶解度随温度变化如右图所示. 回答下列问题: (1)为了加速固体溶解.可采取的措施是: . (2)实验室进行蒸发浓缩操作时.将蒸发皿置于 铁圈上.用酒精灯加热.取用蒸发皿应使用 .为了防止液滴飞溅.进行的操作是 . (3)“趁热过滤 操作中.滤渣的主要成分是 . (4)“趁热过滤 后.有时先往滤液中加入少量水.加热至沸.然后再“冷却结晶 .目的是 . (5)制得的KNO3产品中常含NaCl.进一步提纯的方法是 解析:该题可以说得上是流程题中的经典题目.它很好的考察了物质的分离与提纯中的一些基本操作.也考察了不同性质的物质在分离提纯时所采取的不同方法.特别是考察了温度这一外界因素在制备产品时所起的关键作用.通过前面的分析.我们很快可以得出正确的答案:
网址:http://m.1010jiajiao.com/timu3_id_64378[举报]
实验室以氯化钾和硝酸钠为原料制备硝酸钾的实验流程如下:
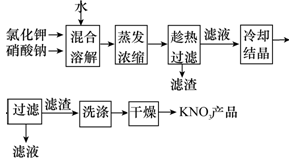
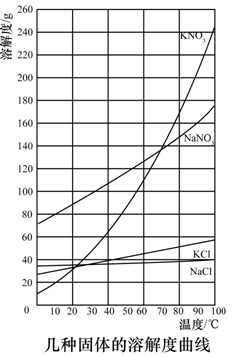
硝酸钾等四种物质的溶解度随温度变化如下图所示。
回答下列问题:
回答下列问题:
(1)为了加速固体溶解,可采取的措施是____________。
(2)实验室进行蒸发浓缩操作时,将蒸发皿置于铁圈上,用酒精灯加热。取用蒸发皿应使用______________(填仪器的名称);为了防止液滴飞溅,进行的操作是__________。
(3)“趁热过滤”操作中,滤渣的主要成分是(填化学式)__________。
(4)“趁热过滤”后,有时先往滤液中加入少量水,加热至沸,然后再 “冷却结晶”,目的是____________。
(5)制得的KNO3产品中常含NaCl,进一步提纯的方法是____________。
查看习题详情和答案>>
(2)实验室进行蒸发浓缩操作时,将蒸发皿置于铁圈上,用酒精灯加热。取用蒸发皿应使用______________(填仪器的名称);为了防止液滴飞溅,进行的操作是__________。
(3)“趁热过滤”操作中,滤渣的主要成分是(填化学式)__________。
(4)“趁热过滤”后,有时先往滤液中加入少量水,加热至沸,然后再 “冷却结晶”,目的是____________。
(5)制得的KNO3产品中常含NaCl,进一步提纯的方法是____________。
下列说法正确的是( )
| A、向K2Cr2O7酸性溶液滴入NaNO2溶液,溶液由橙色变成黄色,体现了NO2-的氧化性 | B、实验室用氯化钾和硝酸钠制备硝酸钾晶体的步骤是:取原料→配成热饱和溶液→冷却结晶→过滤→提纯 | C、乙醇与溴化钠、浓硫酸加热制取溴乙烷时,往往加入少量蒸馏水,主要目的是防止硫酸浓度过大而产生溴单质、二氧化硫等副产物 | D、为精确测定盐酸与氢氧化钠溶液反应的反应热,当两者混合后,立即读取温度计的读数,防止热量散失 |
我国自行研制的优质磷酸二氢钾(KDP)晶体被应用于大功率固体激光器中.现以氯化钾和磷酸为原料制取磷酸二氢钾,反应方程式为:H3PO4(aq)+KCl(aq)?KH2PO4(aq)+HCl(aq),以下是在三正丁胺中制备磷酸二氢钾的工艺流程:
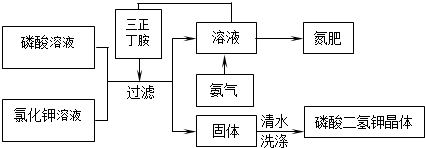
已知:三正丁胺是不溶于水的有机溶剂,与氯化氢反应生成一种可溶于水的盐,能使磷酸二氢钾在水中的溶解度降低.
(1)该流程中所获副产品氮肥的主要成份是
(2)使用三正丁胺能促进该反应进行的原因是
(3)当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl?质量分数低于0.2%.
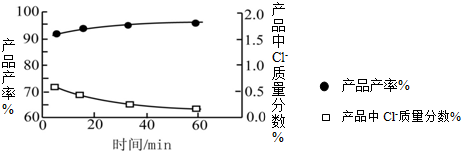
由图中可知,当反应进行到约
查看习题详情和答案>>

已知:三正丁胺是不溶于水的有机溶剂,与氯化氢反应生成一种可溶于水的盐,能使磷酸二氢钾在水中的溶解度降低.
(1)该流程中所获副产品氮肥的主要成份是
氯化铵
氯化铵
.(2)使用三正丁胺能促进该反应进行的原因是
原因是降低KH2PO4溶解度,使其析出后,降低了生成物浓度,(同时生成的HCl与三正丁胺反应,也降低了HCl的浓度),使平衡向正反应方向移动
原因是降低KH2PO4溶解度,使其析出后,降低了生成物浓度,(同时生成的HCl与三正丁胺反应,也降低了HCl的浓度),使平衡向正反应方向移动
.除该方案外,促进该反应进行还可采取的措施有分离出氯化氢
分离出氯化氢
.(3)当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl?质量分数低于0.2%.

由图中可知,当反应进行到约
50-60均可
50-60均可
分钟时,KDP晶体达到一级品标准,此时的产品产率约为95%
95%
.
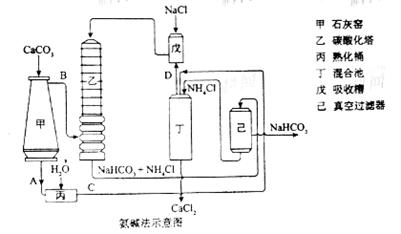
①图中的中间产物C是_______,D_______。(写化学式);
②装置乙中发生反应的化学方程式为_______;[来源:学&科&网]
(3)联合制碱法对氨碱法的改进,其优点是______________;
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?__________。
某兴趣小组在实验室以铜和硫酸为原料,采用多种方法制取硫酸铜。制备方法如下:
方法一:
(1)浓硫酸试剂瓶上贴的标签是____________
方法一:
(1)浓硫酸试剂瓶上贴的标签是____________
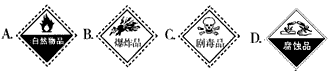
(2)甲同学取6.4 g铜片和10 mL 18 mol/L浓硫酸,放在试管中共热时,发现铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色固体,若将所得灰白色固体蒸干得到白色固体。甲同学为了验证其中白色固体的主要成分。设计了下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象:_________________,
实验结论:所得白色固体的化学式为_______________。
(3)甲还观察到,加热时在试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失。淡黄色固体消失的原因是_________________ (用化学反应方程式表示)。
方法二:
(4)乙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O。对比甲的方案,你认为乙同学设计的实验方案的优点是_______________。
2CuO,CuO+H2SO4=CuSO4+H2O。对比甲的方案,你认为乙同学设计的实验方案的优点是_______________。
方法三:
(5)丙同学取一铜片和稀硫酸于试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色。写出反应的化学方程式:______________。
方法四:
(6)请你再帮助该实验小组的同学设计一种只用铜和稀硫酸制取硫酸铜的方法,写出该方法中的化学反应方程式:_______________。
查看习题详情和答案>>
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌。
实验现象:_________________,
实验结论:所得白色固体的化学式为_______________。
(3)甲还观察到,加热时在试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸而消失。淡黄色固体消失的原因是_________________ (用化学反应方程式表示)。
方法二:
(4)乙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O2
 2CuO,CuO+H2SO4=CuSO4+H2O。对比甲的方案,你认为乙同学设计的实验方案的优点是_______________。
2CuO,CuO+H2SO4=CuSO4+H2O。对比甲的方案,你认为乙同学设计的实验方案的优点是_______________。 方法三:
(5)丙同学取一铜片和稀硫酸于试管中,再向其中滴入双氧水,发现溶液逐渐呈蓝色。写出反应的化学方程式:______________。
方法四:
(6)请你再帮助该实验小组的同学设计一种只用铜和稀硫酸制取硫酸铜的方法,写出该方法中的化学反应方程式:_______________。