网址:http://m.1010jiajiao.com/timu3_id_64376[举报]
某化学兴趣小组全体同学进入一家回收含铜电缆废料的工厂做社会调查,工厂负责人向同学们展示两个处理方案,并向同学们提出下列问题:
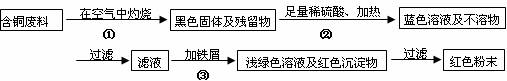
方案甲:
方案乙:
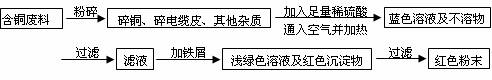
(1)两个方案哪个符合当前生产的绿色理念,为什么?
;
(2)写出方案甲中的②③步骤反应的离子方程式:
;
(3)工厂负责人指出,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,你认为这么说的道理是: ;
(4)用简便方法检验红色粉末中是否含有过量的铁屑 如果有,请你提出合理的处理方案
(5)为了增加经济效益,该工厂把最后一步所得浅绿色滤液通过 、冷却结晶、
、洗涤、自然干燥得到一种俗称“绿矾”的工业产品。
查看习题详情和答案>>某化学兴趣小组全体同学进入一家回收含铜电缆废料的工厂做社会调查,工厂负责人向同学们展示两个处理方案,并向同学们提出下列问题:
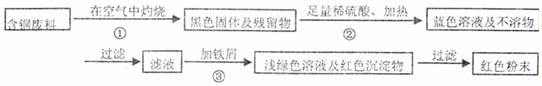
方案甲:
方案乙:
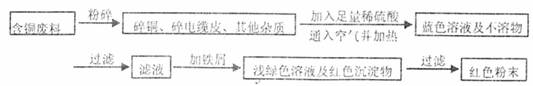
(1)两个方案哪个符合当前生产的绿色理念,为什么?
(2)写出方案甲中的②③步骤反应的离子方程式:
(3)工厂负责人指出,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,你认为这么说的道理是: ;
(4)用简单方法检验红色粉末中是否含有过量的铁屑;如果有请你提出合理的处理方案
;
(5)为了增加经济效益,该工厂把最后一步所得浅绿色滤液通过 、冷却结晶、 、洗涤、自然干燥得到一种俗称“绿矾”的工业产品。
查看习题详情和答案>>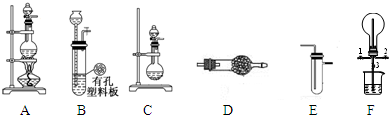
Ⅰ、探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3→N2+6HCl)的反应.实验时打开开关1、3,关闭2,先向烧瓶中通入
Ⅱ、探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是
(5)若利用装置A、E进行乙烯与溴水反应的实验,必须对装置A进行的改动是
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验.F的烧瓶中发生反应的化学方程式为
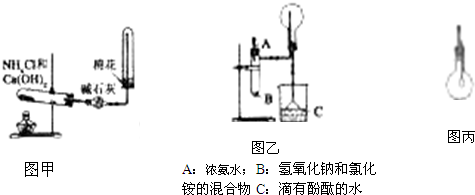
(1)实验室用图甲制备氨气的化学方程式为
(2)NH3分子的空间构型为
(3)图乙是某化学兴趣小组的同学制备氨气并进行性质实验时的改进装置.把浓氨水滴入试管里,立即可观察到试管内发生剧烈反应,有大量气泡产生.
将图乙中收满NH3的圆底烧瓶取下,改装成图丙所示的装置,胶头滴管内先已吸入2mL水,此时小气球系在玻璃管上呈自然松弛状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某项性质.
①下面是某同学关于该化学小组能用图乙制取NH3的原因分析,符合科学性原理的是
A.在NH3?H2O中有平衡:NH3+H2O?NH3?H2O?NH4++OH-,NaOH使平衡向左移动
B.在NH3?H2O中有平衡:NH3+H2O?NH3?H2O?NH4++OH-,NH4Cl使平衡向左移动
C.NaOH溶于水时放热,使体系的温度升高,NH3的溶解度减小,会有部分NH3放出.
D.NH4Cl会分解释放出NH3
②图乙中的NH4Cl与NaOH固体混合物能否用CaO固体代替
③如何判断图乙中烧瓶已收满NH3?
④图丙中随胶头滴管中的水挤入烧瓶中,观察到的现象是
 (2009?汕头二模)甲酸(CH2O2),俗称蚁酸,结构式为:
(2009?汕头二模)甲酸(CH2O2),俗称蚁酸,结构式为: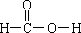
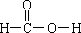
猜想I:甲酸具有酸性;
实验I:在甲酸溶液中滴加紫色石蕊试液;
猜想II:甲酸能发生银镜反应;
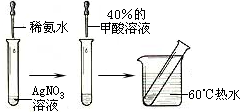
实验II:操作过程如右图所示;
回答下列问题:
(1)请你再设计出至少2个实验方案来验证甲酸的酸性:
(2)请你进一步设计实验方案证明甲酸是弱酸
(3)依右上图所示的实验,加热20分钟后并没有出现预期的实验现象.该小组同学预期的实验现象是
(4)在仔细分析甲酸分子组成元素的基础上,请你再提出一个甲酸在浓硫酸作用下可能具有的性质的猜想并设计一个实验方案验证你的猜想:
①你提出的猜想是
②你设计的实验方案是:


实验方案请参考如下形式:
