摘要:Na2SO3在空气中极易被氧化.现有a g样品.将其溶解后. 加入足量BaCl2溶液.可得干燥的沉淀b g. (1)若Na2SO3未被氧化.b= a. (2)若Na2SO3全部被氧化.b= a. (3)若Na2SO3部分被氧化.b与a的关系式为 .
网址:http://m.1010jiajiao.com/timu3_id_64245[举报]
现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命体不可缺少的重要元素.已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体.B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但有一点是肯定的,那就是没有第三种元素的化合物种数会超出它们.回答下列有关问题:
(1)写出C2A4的电子式
 .C2A4的水溶液呈
.C2A4的水溶液呈
(2)A和B可以形成很多种化合物,用电子式表示A和B形成的最简单化合物的形成过程:
 ,该化合物与CA3和A2D的熔点由高到低的顺序为
,该化合物与CA3和A2D的熔点由高到低的顺序为
(3)燃料电池是一种新型电池.由A、B、D组成的一种日常生活中最常见的有机物与D的单质以KOH溶液为电解质组成电池,引起了人们的普遍重视.写出负极的电极反应式:
(4)E的同素异形体中有一种通常情况下不稳定,在空气中极易自燃,写出该同素异形体的结构式
 ,CA3、A2D、EA3的热稳定性由强到弱的顺序为
,CA3、A2D、EA3的热稳定性由强到弱的顺序为
查看习题详情和答案>>
(1)写出C2A4的电子式


碱
碱
(填“酸”“碱”或“中”)性,1mol C2A4最多可以与2
2
mol HCl发生中和反应生成正盐.C2A4和A2D2 既具有氧化性,又具有还原性,从化合价的角度解释C2A4和A2D2 既具有氧化性又具有还原性的原因N2H4中N显-2,H2O2中O显-1,均为相应元素的中间价态,所以既有氧化性,又有还原性
N2H4中N显-2,H2O2中O显-1,均为相应元素的中间价态,所以既有氧化性,又有还原性
.(2)A和B可以形成很多种化合物,用电子式表示A和B形成的最简单化合物的形成过程:


H2O>NH3>CH4
H2O>NH3>CH4
(用化学式表示).(3)燃料电池是一种新型电池.由A、B、D组成的一种日常生活中最常见的有机物与D的单质以KOH溶液为电解质组成电池,引起了人们的普遍重视.写出负极的电极反应式:
CH3CH2OH-12e-+16OH-═2CO32-+11H2O
CH3CH2OH-12e-+16OH-═2CO32-+11H2O
.(4)E的同素异形体中有一种通常情况下不稳定,在空气中极易自燃,写出该同素异形体的结构式


H2O>NH3>PH3
H2O>NH3>PH3
(用化学式表示).硫酸亚铁是比较重要的亚铁盐,在农业上用作农药,主治小麦黑穗病,在工业上用于染色、制造蓝黑墨水和木材防腐、除草剂等.
(1)实验室条件下用铁粉和稀硫酸制取少量硫酸亚铁溶液,为防止其变质,应在该溶液中应加入适量
(2)新制的绿矾晶体(FeSO4?7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:
(3)已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物.已知SO3的熔点是16.8°C,沸点是44.8°C.
①装置II的试管中不装任何试剂,其作用是
②装置III和装置IV的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
限选试剂:3mol.L-1.H2S04、6mol.L-l NaOH、0.5mol.L -1 BaCl2、O.5mol.L-1Ba(NO3)2、0.01mol.L-1 酸性 KMnO4 溶液、0.0l mol.L-1 溴水.

③装置V的作用是防止尾气污染环境,烧杯中应加入的试剂是
④如何检验装置Ⅰ中固体完全分解后生成固体产物有无FeO?写出步骤、现象及结论:
查看习题详情和答案>>
(1)实验室条件下用铁粉和稀硫酸制取少量硫酸亚铁溶液,为防止其变质,应在该溶液中应加入适量
铁,硫酸
铁,硫酸
.(2)新制的绿矾晶体(FeSO4?7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:
4FeSO4?7H2O+O2=4Fe(OH)SO4+5H2O
4FeSO4?7H2O+O2=4Fe(OH)SO4+5H2O
.(3)已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物.已知SO3的熔点是16.8°C,沸点是44.8°C.
①装置II的试管中不装任何试剂,其作用是
防止溶液倒吸入装置Ⅰ中(或安全瓶)
防止溶液倒吸入装置Ⅰ中(或安全瓶)
,试管浸泡在50℃的热水浴中,目的是防止SO3液化或凝固
防止SO3液化或凝固
.②装置III和装置IV的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
限选试剂:3mol.L-1.H2S04、6mol.L-l NaOH、0.5mol.L -1 BaCl2、O.5mol.L-1Ba(NO3)2、0.01mol.L-1 酸性 KMnO4 溶液、0.0l mol.L-1 溴水.

| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量 0.5mol.L-1BaCl2 0.5mol.L-1BaCl2 . |
产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量 0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水) 0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水) . |
若溶液紫色(或橙色)褪去,证明气体产物中含有SO2, 若溶液紫色(或橙色)褪去,证明气体产物中含有SO2, 若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 . |
NaOH溶液
NaOH溶液
.④如何检验装置Ⅰ中固体完全分解后生成固体产物有无FeO?写出步骤、现象及结论:
取少量分解后剩余固体于试管中,往试管中加入足量稀盐酸,充分反应后,滴入酸性KMnO4溶液,若酸性KMnO4溶液褪色,说明生成的固体产物含有FeO
取少量分解后剩余固体于试管中,往试管中加入足量稀盐酸,充分反应后,滴入酸性KMnO4溶液,若酸性KMnO4溶液褪色,说明生成的固体产物含有FeO
. 金属和非金属与人类生活、生产密不可分.
金属和非金属与人类生活、生产密不可分.(1)我国多使用铁锅炒菜,铁锅在
(2)清末铝制艺术品至今保存完好,艺术品未被锈蚀的主要原因是(填字母)
A.铝不易被氧化
B.铝的金属活动性比较弱
C.铝表面的氧化膜具有保护作用
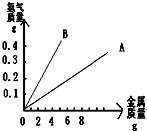
(3)如图为金属与过量盐酸反应的关系图,其中A、B两条直线分别代表镁、铁、锌三种金属中的两种.A代表的是(填元素符号)
高纯硅是制造计算机电路芯片的主要原料.请回答:
①硅元素属于
②硅在氧气中燃烧生成二氧化硅,并放出大量的热,可作未来新能源,该反应的基本反应类型为
③工业上用石英(主要成分为SiO2)制备粗硅的反应为:SiO2+2C
| ||
④生产高纯硅可用三氯硅烷(SiHCl3).三氯硅烷在空气中极易燃烧,燃烧时可观察到有红色火焰和白色烟,生成物为二氧化硅、氯化氢和氯气,此反应的化学方程式为
(2013?无锡一模)从含镁、钾盐湖水中蒸发最后得到的产物中含光卤石(xKCl?yMgCl2?zH2O),它在空气中极易潮解、易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:
①准确称取5.550g样品溶于水,配成100mL溶液.
②将溶液分成两等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580g.
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305g.
(1)步骤②中检验白色固体已洗净的方法是
(2)已知某温度下Mg(OH)2的Ksp=6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5mol?L-1可视为沉淀完全,则应保持溶液中c(OH-)≥
(3)通过计算确定样品的组成(写出计算过程).
查看习题详情和答案>>
①准确称取5.550g样品溶于水,配成100mL溶液.
②将溶液分成两等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580g.
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305g.
(1)步骤②中检验白色固体已洗净的方法是
取最后的洗涤液,滴加AgNO3溶液,若不产生沉淀,则已洗净
取最后的洗涤液,滴加AgNO3溶液,若不产生沉淀,则已洗净
.(2)已知某温度下Mg(OH)2的Ksp=6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5mol?L-1可视为沉淀完全,则应保持溶液中c(OH-)≥
8×10-4
8×10-4
mol?L-1(3)通过计算确定样品的组成(写出计算过程).
(2013?和平区二模)四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.装置A中放浓盐硫,B中放MnO2,二者用于制氯气,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热).请回答下列各问题.
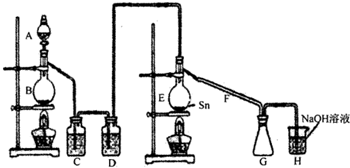
(1)图中气体发生和尾气处理装置不够完善,请你提出改进意见
利用改进后的正确装置进行实验,请回答下列问题:
(2)H中反应的离子方程式:
(3)C、D中的试剂分别是
(4)仪器A、B的名称分别是
(5)实验时应先点燃
(6)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为
(7)如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是
查看习题详情和答案>>

(1)图中气体发生和尾气处理装置不够完善,请你提出改进意见
用导管将A的上口与B相连;在G、H之间增加干燥装置
用导管将A的上口与B相连;在G、H之间增加干燥装置
.利用改进后的正确装置进行实验,请回答下列问题:
(2)H中反应的离子方程式:
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
;E中反应的化学方程式:Sn+2Cl2
SnCl4
| ||
Sn+2Cl2
SnCl4
.
| ||
(3)C、D中的试剂分别是
饱和食盐水
饱和食盐水
、浓硫酸
浓硫酸
.(4)仪器A、B的名称分别是
分液漏斗
分液漏斗
、蒸馏烧瓶
蒸馏烧瓶
,F的作用是导气、冷凝
导气、冷凝
.(5)实验时应先点燃
E
E
处酒精灯,加热温度应大于231
231
℃,待锡融化
锡融化
即可停止加热.(6)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为
SnCl4+2H2O=SnO2+4HCl
SnCl4+2H2O=SnO2+4HCl
.(7)如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是
出现白色烟雾
出现白色烟雾
.