摘要:三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的氮氧化物(如NO2).当加热至一定温度时.它发生如下分解:C3N3(OH)3===3HNCO.HNCO(异氰酸.其结构是H-N==C-O)能和NO2反应生成N2.CO2和H2O. (1)写出HNCO和NO2反应的化学方程式.分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目. (2)如按上述反应式进行反应.试计算吸收1.0 kg NO2气体消耗的三聚氰酸的质量.
网址:http://m.1010jiajiao.com/timu3_id_64171[举报]
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
① C3N3(OH)3
 3HNCO
3HNCO
② 8HNCO+6NO2  7N2+8CO2+4H2O
7N2+8CO2+4H2O
(两个方程式中所有碳元素的化合价均为+4)
下列说法正确的是
A.反应①、②均是氧化还原反应
B.反应②中N2既是氧化产物、又是还原产物
C.反应②中,每转移1mol电子,NO2被氧化 0.25 mol
D.反应②中氧化剂、还原剂的物质的量之比为4∶3
查看习题详情和答案>>
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:C3N3(OH)3![]() 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2![]() 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是 ( )
A.C3N3(OH)3与HNCO为同一物质
B.HNCO是一种很强的氧化剂
C.1 mol NO2在反应中转移的电子为4 mol
D.反应中NO2是还原剂
查看习题详情和答案>>三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
① C3N3(OH)3 3HNCO
3HNCO
② 8HNCO+6NO2 7N2+8CO2+4H2O
7N2+8CO2+4H2O
(两个方程式中所有碳元素的化合价均为+4)
下列说法正确的是
| A.反应①、②均是氧化还原反应 |
| B.反应②中N2既是氧化产物、又是还原产物 |
| C.反应②中,每转移1mol电子,NO2被氧化0.25 mol |
| D.反应②中氧化剂、还原剂的物质的量之比为4∶3 |
 3HNCO
3HNCO 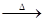 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2