摘要:16.已知某一温度下:H2(g)+CO2(g) CO(g)+H2O(g). K=1,现往1.0L的密闭容器中投入1.0molH2以及2.0molCO2. (1)求反应达到平衡后两物质的转化率分别为多少? (2)若保持相同的条件,改为投入1.0molH2以及4.0molCO2.求反应达到平衡后两物质的转化率又分别为多少? (3)通过上面的计算.若在化工生产中得到启示是: .
网址:http://m.1010jiajiao.com/timu3_id_63366[举报]
已知某化学反应的平衡常数表达式为K=
,在不同的温度下该反应的平衡常数如下表:
下列有关叙述不正确的是( )
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A、该反应的化学方程式是CO(g)+H2O(g)═CO2(g)+H2(g) | ||||
| B、上述反应的正反应是放热反应 | ||||
| C、若在一定体积的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应达到平衡状态 | ||||
D、若平衡浓度符合下列关系式:
|
已知某化学反应的平衡常数表达式为K= ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
A.该反应的化学方程式是:CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol时,该反应为平衡状态
D.某温度下,如果平衡浓度符合下列关系式:
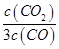 =
=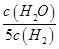 ,判断此时的温度是1000 ℃
查看习题详情和答案>>
,判断此时的温度是1000 ℃
查看习题详情和答案>>
已知某化学反应的平衡常数表达式为K= ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
A.该反应的化学方程式是:CO(g)+H2O(g)
 CO2(g)+H2(g)
CO2(g)+H2(g)B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol时,该反应为平衡状态
D.某温度下,如果平衡浓度符合下列关系式:
 ,判断此时的温度是1000 ℃
查看习题详情和答案>>
,判断此时的温度是1000 ℃
查看习题详情和答案>>
已知某化学反应的平衡常数表达式为 ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
1.67 |
1.11 |
1.00 |
0.60 |
0.38 |
有关叙述错误的是
A.该反应的化学方程式是:CO(g)+H2O(g) 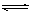 CO2(g)+H2(g)
CO2(g)+H2(g)
B.该反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO和H2O各1 mol,再把温度升高到830 ℃,此时测得CO2为0.4 mol时,这时可逆反应处于平衡状态
D.若平衡浓度关系符合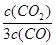 =
=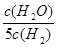 ,可判断此时温度是1000 ℃
,可判断此时温度是1000 ℃
查看习题详情和答案>>
已知某化学反应的平衡常数表达式为K=
,在不同的温度下该反应的平衡常数值分别为:
下列有关叙述错误的是( )
查看习题详情和答案>>
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A.该反应的化学方程式是:CO(g)+H2O(g)?CO2(g)+H2(g) | ||||
| B.上述反应的正反应是放热反应 | ||||
| C.如果在一定体积的密闭容器中加入CO和H2O各1 mol,再把温度升高到830℃,此时测得CO2为0.4 mol时,这时可逆反应处于平衡状态 | ||||
D.若平衡浓度关系符合
|