摘要:12.氨是重要的化工原料.某工厂以天然气.水蒸气和空气为原料合成氨的流程如下: 上述流程中外热式一级烃转化器:系指以CH4为燃料在烃气转化器外面加热使之维持800℃高温的工业装置.内热式二级烃气转化器:系指以H2在装置内燃烧为能量维护一级烃气转化器所生成的CO与H2O(气)反应生成CO2和H2所需1000℃高温的装置.在编号为i-v的反应器中发生如下反应: (a)CH4+2O2 → CO2+2H2O (b)CH4+H2O(g) → CO+3H2 (c)2CH4+3H2O(g) → CO+CO2+7H2 (d)K2CO3+CO2+H2O → 2KHCO3 (e)CO+H2OCO2+H2 ,ΔH<0 (f)2H2+O2 → 2H2O (1)写出e反应的平衡常数表达式K= .若只增加H2O的浓度,该反应的正反应速率 .平衡常数 (填“增大 .“减小 .“不变 ). 发生在编号为 的反应器中.它的作用是 . (3)属于制备合成氨原料气的反应有 .反应(d)的作用是 . (4)为什么转化反应要分两步--第一步在400℃时进行,第二步在200℃时进行? .
网址:http://m.1010jiajiao.com/timu3_id_63362[举报]
(10分)(1) 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H-H键能为436KJ·mol-1,N≡N键能为945 KJ·mol-1,N-H键能为391 KJ·mol-1。写出合成氨反应的热化学方程式:
(2)可逆反应N2 +3H2 2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
①单位时问内生成n mo1 N2的同时生成3n mol H2
②单位时间内1个N≡N键断裂的同时,有6个N—H键断裂
③容器中N2、H2、NH3的物质的量为1:3:2
④常温下,混合气体的密度不再改变的状态
⑤常温下,混合气体的平均相对分子质量不再改变的状态
(3)恒温下,往一个2L的密闭容器中充入2.6 mol H2和1 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所:
5min内,消耗N2的平均反应速率为 ;此条件下该反应的化学平衡常数K= ;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,化学平衡将向 (填“正反应”或“逆反应”)方向移动。
(4)氨是氮肥工业的重要原料。某化肥厂以天然石膏矿(主要成分CaSO4)为原料生产铵态氮肥(NH4)2SO4,(已知Ksp(CaSO4)=7.10×10-5 Ksp(CaCO3)=4.96×10-9)其工艺流程如下:
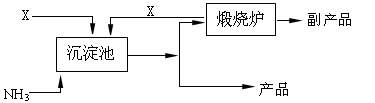
请写出制备(NH4)2SO4的反应方程式: ;
并利用有关数据简述上述反应能发生的原因
(1)已知:H-H键能为436KJ·mol-1,N≡N键能为945 KJ·mol-1,N-H键能为391 KJ·mol-1。写出合成氨反应的热化学方程式:
(2)可逆反应N2 +3H2
 2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
2NH3 在恒容密闭容器中进行,达到平衡状态的标志是 ①单位时问内生成n mo1 N2的同时生成3n mol H2
②单位时间内1个N≡N键断裂的同时,有6个N—H键断裂
③容器中N2、H2、NH3的物质的量为1:3:2
④常温下,混合气体的密度不再改变的状态
⑤常温下,混合气体的平均相对分子质量不再改变的状态
(3)恒温下,往一个2L的密闭容器中充入2.6 mol H2和1 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
(4)氨是氮肥工业的重要原料。某化肥厂以天然石膏矿(主要成分CaSO4)为原料生产铵态氮肥(NH4)2SO4,(已知Ksp(CaSO4)=7.10×10-5 Ksp(CaCO3)=4.96×10-9)其工艺流程如下:

请写出制备(NH4)2SO4的反应方程式: ;
并利用有关数据简述上述反应能发生的原因
(12分)利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式 。
(2)500℃、50MPa时,在容积为V L的容器中加入1 molN2、3 mol H2,,此时N2的转化率为a。则平衡时NH3的浓度为 。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2OCO+H2 CH4+H2O
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭 吨、甲烷 吨,
才能满足生产需要。
查看习题详情和答案>>
(12分)利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=C O+3H2。部分物质的燃烧热数据如下表:
O+3H2。部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
 4.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式
4.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式  。
。(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,,此时N2的转化率为a。则平衡时NH3的浓度为 。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:

某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O
 CO+H2 CH4+H2O
CO+H2 CH4+H2O CO+3H2
CO+3H2假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭 吨、甲烷 吨,
才能满足生产需要。 查看习题详情和答案>>
利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表

已知1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式
_________________________。
(2)500℃、50MPa时,在容积为VL的容器中加入1mol N2、3mol H2,此时N2的转化率为a。则平衡时
NH3的浓度为______________。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下
_________________________。
(2)500℃、50MPa时,在容积为VL的容器中加入1mol N2、3mol H2,此时N2的转化率为a。则平衡时
NH3的浓度为______________。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下
CH2=CH2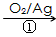
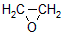
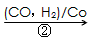 HOCH2CH2CHO
HOCH2CH2CHO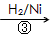 HOCH2CH2CH2OH
HOCH2CH2CH2OH
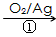
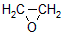
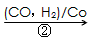 HOCH2CH2CHO
HOCH2CH2CHO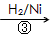 HOCH2CH2CH2OH
HOCH2CH2CH2OH 某化工厂已购得乙烯11.2t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得
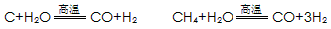
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭___________吨、甲烷_________吨,才能满足生产需要。
查看习题详情和答案>>
(12分)利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=C O+3H2。部分物质的燃烧热数据如下表:
O+3H2。部分物质的燃烧热数据如下表:
已知1 mol H2O(g)转变为1 mol H2O(l)时放出4 4.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式
4.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式  。
。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,,此时N2的转化率为a。则平衡时NH3的浓度为 。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:

某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O CO+H2 CH4+H2O
CO+H2 CH4+H2O CO+3H2
CO+3H2
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭 吨、甲烷 吨,
才能满足生产需要。
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=C
 O+3H2。部分物质的燃烧热数据如下表:
O+3H2。部分物质的燃烧热数据如下表:| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
 4.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式
4.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式  。
。(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,,此时N2的转化率为a。则平衡时NH3的浓度为 。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:

某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O
 CO+H2 CH4+H2O
CO+H2 CH4+H2O CO+3H2
CO+3H2假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭 吨、甲烷 吨,
才能满足生产需要。