摘要:19.已知25℃时.CH3COOH和NH3·H2O的电离平衡常数分别为Ka(CH3COOH)=1.7×10-5mol/L.Kb(NH3·H2O)=1.7×10-5mol/L.现有常温下1mol/L的醋酸溶液和1mol/L的氨水.且知醋酸溶液的pH=a.试回答下列问题: (1)醋酸溶液中存在的电离平衡用电离方程式为表示为 . 相同条件下.该浓度的氨水的pH= . (2)将上述两种溶液等体积混合.所得溶液的pH= . 2悬浊液中加入适量的饱和氯化铵溶液.结果固体完全溶解. 甲同学的解释是: Mg(OH)2Mg2+ +2OH- ① NH4+ +H2ONH3·H2O + H+ ② H+ + OH- == H2O ③ 由于反应③的发生.使平衡①右移.沉淀溶解. 乙同学的解释是: Mg(OH)2Mg2+ +2OH- ① NH4Cl=== NH4+ + Cl- ② NH4++ OH- NH3·H2O ③ 由于反应③的发生.使平衡①右移.沉淀溶解. 已知在一定温度下.稀醋酸和稀氨水的电离度相等.请你用一种试剂.设计一个实验.证明甲或乙的观点的正确性.写出实验步骤和实验结论. .
网址:http://m.1010jiajiao.com/timu3_id_63349[举报]
(9分)已知25℃时,CH3COOH和NH3·H2O的电离平衡常数分别为Ka(CH3COOH)=l.7×10-5mol/L,Kb(NH3·H2O)=1.7×l0-5mol/L。现有常温下1 mol/L的醋酸溶液和l mol/L的氨水,且知醋酸溶液的pH=a,试回答下列问题:
(1)醋酸溶液中存在的电离平衡用电离方程式表示为 ,
(2)将上述两种溶液等体积混合,所得溶液的pH= 。
(3)饱和氯化铵溶液显酸性,原因是(用离子方程式表示) ;向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解。甲、乙两位同学分别提出了不同的解释:
甲同学:由于NH4+水解呈酸性,其H+结合Mg(OH)2电离的OH-,使Mg(OH)2溶解
乙同学:由于Mg(OH)2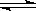 Mg2++2OH-,NH4++OH-
Mg2++2OH-,NH4++OH-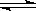 NH3·H2O,使Mg(OH)2溶解。请你设计一个实验验证两位同学的解释 。
NH3·H2O,使Mg(OH)2溶解。请你设计一个实验验证两位同学的解释 。
(9分)已知25℃时,CH3COOH和NH3·H2O的电离平衡常数分别为Ka(CH3COOH)=l.7×10-5mol/L,Kb(NH3·H2O)=1.7×l0-5mol/L。现有常温下1 mol/L的醋酸溶液和l mol/L的氨水,且知醋酸溶液的pH=a,试回答下列问题:
(1)醋酸溶液中存在的电离平衡用电离方程式表示为 ,
(2)将上述两种溶液等体积混合,所得溶液的pH= 。
(3)饱和氯化铵溶液显酸性,原因是(用离子方程式表示) ;向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解。甲、乙两位同学分别提出了不同的解释:
甲同学:由于NH4+水解呈酸性,其H+结合Mg(OH)2电离的OH-,使Mg(OH)2溶解
乙同学:由于Mg(OH)2 Mg2++2OH-,NH4++OH-
Mg2++2OH-,NH4++OH- NH3·H2O,使Mg(OH)2溶解。请你设计一个实验验证两位同学的解释 。
NH3·H2O,使Mg(OH)2溶解。请你设计一个实验验证两位同学的解释 。
(1)醋酸溶液中存在的电离平衡用电离方程式表示为 ,
(2)将上述两种溶液等体积混合,所得溶液的pH= 。
(3)饱和氯化铵溶液显酸性,原因是(用离子方程式表示) ;向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解。甲、乙两位同学分别提出了不同的解释:
甲同学:由于NH4+水解呈酸性,其H+结合Mg(OH)2电离的OH-,使Mg(OH)2溶解
乙同学:由于Mg(OH)2
 Mg2++2OH-,NH4++OH-
Mg2++2OH-,NH4++OH- NH3·H2O,使Mg(OH)2溶解。请你设计一个实验验证两位同学的解释 。
NH3·H2O,使Mg(OH)2溶解。请你设计一个实验验证两位同学的解释 。