摘要:12.在两支试管中分别加入3mL 2mol·L-1的稀盐酸.将两个各装有0.3gNaHCO3和0.3g Na2CO3粉末的小气球分别套在试管口.将气球内的NaHCO3或Na2CO3同时倒入试管中.观察到的现象如下: (1)试管中(填产生沉淀或气体及反应速率等相关现象) . (2)盛 的试管中气球变得更大.大小气球体积之比约为 . (3)甲同学用手触摸试管.发现盛NaHCO3粉末的试管变冷.而盛Na2CO3的试管温度有所升高.由此他得出:不管其状态如何.NaHCO3和HCl反应为吸热反应.而Na2CO3和HCl反应为放热反应.类似如中和热.甲同学写出了下列热化学方程式: HCO3– (aq)+H+(aq)=H2O(l)+CO2(g),ΔH>0 CO32– (aq)+2H+(aq)=H2O(l)+CO2(g),ΔH<0 甲同学下结论的方法是否正确 . (4)为研究上述反应是吸热还是放热反应.继续进行了下列实验(每次实验各做3次平行实验.取平均值): 序号 试剂1 试剂2 混合前温度 混合后最高或最低温度 ① 35mL水 2.5g NaHCO3固体 20℃ 18.5℃ ② 35mL水 3.2 Na2CO3固体 20℃ 24.3℃ ③ 35mL稀盐酸 含2.5g NaHCO3的饱和溶液32.5mL 20℃ 19℃ ④ 35mL稀盐酸 含3.2g Na2CO3的饱和溶液23.1mL +10ml水 20℃ 24.2℃ ⑤ 35mL稀盐酸 2.5gNaHCO3固体 20℃ 16.2℃ ⑥ 35mL稀盐酸 3.2g Na2CO3固体 20℃ 25.1℃ 请你帮助填写相关内容: 该研究报告的题目是< >, 该实验中所用的仪器除试管.药匙.气球.玻璃棒.烧杯.量筒.保温瓶外.还需要的仪器名称为 和 , 通过上述实验可得出五条结论: a:NaHCO3的溶解是 (填“吸热 或“放热 .下同)过程, b:Na2CO3的溶解是 过程, c:NaHCO3的饱和溶液和盐酸的反应是 反应, d:Na2CO3的饱和溶液和盐酸的反应是 反应, e:NaHCO3固体与稀盐酸反应的反应热是由 的热效应之和.
网址:http://m.1010jiajiao.com/timu3_id_63209[举报]
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个分别装有0.3g NaHCO3、0.3g Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3、Na2CO3同时倒入试管中,观察.反应方程式:NaHCO3+HCl═NaCl+H2O+CO2↑
Na2CO3+2HCl═2NaCl+H2O+CO2↑
①两试管中气球大小(包含试管) 体积之比约为(填最简单整数比)(盐酸均足量) ;
②甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲下结论的方法是否正确 (填正确或不正确)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做了3次平行实验,取平均值)
请你帮助填写相关内容:
①该研究报告的题目是《 》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为 和 ;通过上述实验可得出多条结论,如:
a:NaHCO3的溶解是 (吸热或放热)过程;
b:Na2CO3的饱和溶液和盐酸的反应是 (吸热或放热)反应.
查看习题详情和答案>>
Na2CO3+2HCl═2NaCl+H2O+CO2↑
①两试管中气球大小(包含试管) 体积之比约为(填最简单整数比)(盐酸均足量)
②甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲下结论的方法是否正确
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做了3次平行实验,取平均值)
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| ① | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
| ② | 50mL水 | 3.2gNa2CO3固体 | 20℃ | 23.0℃ |
| ③ | 35mL稀盐酸 | 含2.5gNaHCO3的饱和溶液15mL | 20℃ | 18.8℃ |
| ④ | 35mL稀盐酸 | 含3.2gNa2CO3的饱和溶液15mL水 | 20℃ | 20.6℃ |
| ⑤ | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 17.4℃ |
| ⑥ | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 23.5℃ |
①该研究报告的题目是《
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为
a:NaHCO3的溶解是
b:Na2CO3的饱和溶液和盐酸的反应是
(2012?河东区一模)下列实验设计不能达到预期目的是( )
|
查看习题详情和答案>>
探究实验:检验 Fe2+的方法
实验步骤:(1)在两支试管中分别加入10mlFeCl3和10mlFeCl2溶液,然后各滴入几滴KSCN溶液,观察现象.
(2)在盛有FeCl2和KSCN溶液的试管中滴入几滴新配置的氯水,观察现象.
(1)实验现象:步骤1中盛10mlFeCl2溶液的试管中溶液
(2)步骤2中涉及的氧化还原反应的离子方程式为:
(3)欲证明某溶液中不含Fe3+可能含有Fe2+,下列实验操作的最佳顺序为
①加少量氯水 ②加少量KMnO4溶液 ③加少量KSCN
A、①③B、②③C、③①D、①②
查看习题详情和答案>>
实验步骤:(1)在两支试管中分别加入10mlFeCl3和10mlFeCl2溶液,然后各滴入几滴KSCN溶液,观察现象.
(2)在盛有FeCl2和KSCN溶液的试管中滴入几滴新配置的氯水,观察现象.
(1)实验现象:步骤1中盛10mlFeCl2溶液的试管中溶液
无明显现象
无明显现象
步骤2中溶液溶液变为血红色
溶液变为血红色
(2)步骤2中涉及的氧化还原反应的离子方程式为:
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
(3)欲证明某溶液中不含Fe3+可能含有Fe2+,下列实验操作的最佳顺序为
c
c
①加少量氯水 ②加少量KMnO4溶液 ③加少量KSCN
A、①③B、②③C、③①D、①②
原高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个各装有0.3g NaHCO3或 Na2CO3粉末的小气球分别套在两支试管口,将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
(1)两支试管均产生大量气体,投入
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲同学写出了下列热化学方程式(其中“aq”的含义是表示水溶液):HCO3-(aq)+H+(aq)=H2O(l)+CO2(g)△H>0 CO32-(aq)+2H+(aq)=H2O(l)+CO2(g)△H<0
甲下结论的方法是否正确
请你帮助填写相关内容:
该研究报告的题目可拟为《
通过上述实验可得出四条结论:
①NaHCO3的溶解是
②Na2CO3的溶解是
③NaHCO3的饱和溶液和盐酸的反应是
④Na2CO3的饱和溶液和盐酸的反应是
查看习题详情和答案>>
(1)两支试管均产生大量气体,投入
NaHCO3
NaHCO3
的试管中气体产生较快,投入NaHCO3
NaHCO3
的试管中气球变得更大(以上均填化学式).(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲同学写出了下列热化学方程式(其中“aq”的含义是表示水溶液):HCO3-(aq)+H+(aq)=H2O(l)+CO2(g)△H>0 CO32-(aq)+2H+(aq)=H2O(l)+CO2(g)△H<0
甲下结论的方法是否正确
不正确
不正确
(填“正确”或“不正确”);为研究是吸热还是放热反应,乙同学继续进行了下列实验(每次实验各做3次平行实验,取平均值):| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高 或最低温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
该研究报告的题目可拟为《
NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究(或相关内容)
NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究(或相关内容)
》通过上述实验可得出四条结论:
①NaHCO3的溶解是
吸热
吸热
(填“吸热”或“放热”)过程;②Na2CO3的溶解是
放热
放热
(填“吸热”或“放热”)过程;③NaHCO3的饱和溶液和盐酸的反应是
吸热
吸热
(填“吸热”或“放热”)反应;④Na2CO3的饱和溶液和盐酸的反应是
放热
放热
(填“吸热”或“放热”)反应.用数轴表示化学知识,并按某种共性对化学物质进行分类,有简明易记的效果.例如,根据碳素钢的含碳量,将其分为低碳钢、中碳钢和高碳钢,利用数轴的分类法可将其表示为
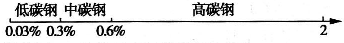
根据这一分类法回答下列问题:
(1)将pH与溶液酸碱性的关系粗略地表示在如下数轴上(常温下):
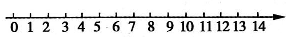
(2)某化学兴趣小组欲研究H2SO4、KCl、Na2SO3、Na2CO3、NaCl、NaOH的性质,对于如何研究,他们设计了两种方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验.
方案Ⅱ:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,边行实验.
①根据方案Ⅰ进行分类时,经实验测得KCl、NaCl溶液的pH等于7;H2SO4溶液的pH小于7;Na2SO3、Na2CO3、NaOH溶液的pH大于7.由此有的同学按分类法思想把Na2SO3、Na2CO3与NaOH都划分为碱类,这样划分是否合理?为什么?
②在方案Ⅰ中,某同学发现盐类物质中的KCl和NaCl两种物质,它们在与其他物质混合时现象相同,无法区分,请你设计一种简单的方法区分这两种物质:
③在方案Ⅱ中,三种钠盐用其他化合物中的
④该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述六种物质分为Na2SO3、Na2CO3、NaCl、NaOH和H2SO4、KCl两类.在用H2SO4鉴别四种含钠元素的物质时,Na2SO3和Na2CO3,很容易区分,但鉴别NaCl和NaOH时却陷入了困境,请你帮忙解决这一难题(试剂只限于上述六种物质):
查看习题详情和答案>>
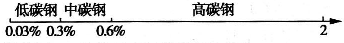
根据这一分类法回答下列问题:
(1)将pH与溶液酸碱性的关系粗略地表示在如下数轴上(常温下):
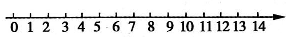
(2)某化学兴趣小组欲研究H2SO4、KCl、Na2SO3、Na2CO3、NaCl、NaOH的性质,对于如何研究,他们设计了两种方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验.
方案Ⅱ:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,边行实验.
①根据方案Ⅰ进行分类时,经实验测得KCl、NaCl溶液的pH等于7;H2SO4溶液的pH小于7;Na2SO3、Na2CO3、NaOH溶液的pH大于7.由此有的同学按分类法思想把Na2SO3、Na2CO3与NaOH都划分为碱类,这样划分是否合理?为什么?
②在方案Ⅰ中,某同学发现盐类物质中的KCl和NaCl两种物质,它们在与其他物质混合时现象相同,无法区分,请你设计一种简单的方法区分这两种物质:
焰色反应透过钴玻璃呈紫色说明是氯化钾,焰色反应呈黄色为氯化钠
焰色反应透过钴玻璃呈紫色说明是氯化钾,焰色反应呈黄色为氯化钠
.③在方案Ⅱ中,三种钠盐用其他化合物中的
H2SO4
H2SO4
可加以区分,有关反应的化学方程式分别为H2SO4+Na2CO3=Na2SO4+CO2↑+H2O H2SO4+Na2SO3=Na2SO4+SO2↑+H2O
H2SO4+Na2CO3=Na2SO4+CO2↑+H2O H2SO4+Na2SO3=Na2SO4+SO2↑+H2O
.④该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述六种物质分为Na2SO3、Na2CO3、NaCl、NaOH和H2SO4、KCl两类.在用H2SO4鉴别四种含钠元素的物质时,Na2SO3和Na2CO3,很容易区分,但鉴别NaCl和NaOH时却陷入了困境,请你帮忙解决这一难题(试剂只限于上述六种物质):
在两支试管中分别加入少许硫酸溶液,分别加入稍过量的两种未知溶液,充分混合,再向混合液中分别滴入碳酸钠溶液,若有气泡生成,则加入的未知液为NaCl,若无气泡生成,则加入的未知液为NaOH溶液;
在两支试管中分别加入少许硫酸溶液,分别加入稍过量的两种未知溶液,充分混合,再向混合液中分别滴入碳酸钠溶液,若有气泡生成,则加入的未知液为NaCl,若无气泡生成,则加入的未知液为NaOH溶液;
.