摘要: 钠.铁两种金属单质及其化合物在生产.生活中有着广泛的应用.请回答: (1)两种金属中.最高价氧化物的水化物属于强碱的是 .由此说明.钠的金属性比铁 . (2)某些补铁剂的成分是硫酸亚铁.长期放置会因氧化而变质.检验硫酸亚铁是否变质的试剂是 . ① 稀盐酸 ② 石蕊溶液 ③ KSCN溶液 (3)向硫酸亚铁溶液中滴入氢氧化钠溶液.生成的灰白色沉淀迅速变成灰绿色.最后变成红褐色.此过程中涉及的氧化还原反应的化学方程式为 . 答案.Na -------------------------1分 强 -------------------------1分 (2) ③ -------------------------1分 2+O2+2H2O = 4Fe(OH)3 ------------ 1分
网址:http://m.1010jiajiao.com/timu3_id_62753[举报]
(4分)钠、铁两种金属单质及其化合物在生产、生活中有着广泛的应用。请回答:
(1)两种金属中,最高价氧化物的水化物属于强碱的是____,由此说明,钠的金属性比铁____(填“强”或“弱”)。
(2)某些补铁剂的成分是硫酸亚铁,长期放置会因氧化而变质。检验硫酸亚铁是否变质的试剂是____(填序号)。
① 稀盐酸 ② 石蕊溶液 ③ KSCN溶液
(3)向硫酸亚铁溶液中滴入氢氧化钠溶液,生成的灰白色沉淀迅速变成灰绿色,最后变成红褐色,此过程中涉及的氧化还原反应的化学方程式为
查看习题详情和答案>>
铝、铁两种金属的单质及其化合物在生产、生活中有着广泛的应用.请回答:
(1)两种金属与稀盐酸反应,除都生成氢气外,还分别生成的物质是
(2)将饱和氯化铁溶液滴入沸水中,得到Fe(OH)3胶体.当光束通过下列物质时,能观察到丁达尔效应的是
①氯化铁溶液 ②Fe(OH)3胶体
(3)向盛有氢氧化铝悬浊液的试管中滴加氢氧化钠溶液,得到无色透明溶液,该反应的离子方程式为
查看习题详情和答案>>
(1)两种金属与稀盐酸反应,除都生成氢气外,还分别生成的物质是
AlCl3
AlCl3
、FeCl2
FeCl2
(填化学式).(2)将饱和氯化铁溶液滴入沸水中,得到Fe(OH)3胶体.当光束通过下列物质时,能观察到丁达尔效应的是
②
②
(填序号).①氯化铁溶液 ②Fe(OH)3胶体
(3)向盛有氢氧化铝悬浊液的试管中滴加氢氧化钠溶液,得到无色透明溶液,该反应的离子方程式为
Al(OH)3+OH-═NaAlO2+2H2O
Al(OH)3+OH-═NaAlO2+2H2O
.(4分)铝、铁两种金属的单质及其化合物在生产、生活中有着广泛的应用。请回答:
(1)两种金属与稀盐酸反应,除都生成氢气外,还分别生成的物质是
_ ___、__ __(填化学式)。
(2)将饱和氯化铁溶液滴入沸水中,得到Fe(OH)3 胶体。当光束通过下列物质时,能观察到丁
达尔效应的是__ __(填序号)。
①氯化铁溶液 ② Fe(OH)3 胶体
(3)向盛有氢氧化铝悬浊液的试管中滴加氢氧化钠溶液,得到无色透明溶液,该反应的离子方
程式为 。
(4分)铝、铁两种金属的单质及其化合物在生产、生活中有着广泛的应用。请回答:
(1)两种金属与稀盐酸反应,除都生成氢气外,还分别生成的物质是
_ ___、__ __(填化学式)。
(2)将饱和氯化铁溶液滴入沸水中,得到Fe(OH)3 胶体。当光束通过下列物质时,能观察到丁
达尔效应的是__ __(填序号)。
①氯化铁溶液 ② Fe(OH)3 胶体
(3)向盛有氢氧化铝悬浊液的试管中滴加氢氧化钠溶液,得到无色透明溶液,该反应的离子方
程式为 。
(1)两种金属与稀盐酸反应,除都生成氢气外,还分别生成的物质是
_ ___、__ __(填化学式)。
(2)将饱和氯化铁溶液滴入沸水中,得到Fe(OH)3 胶体。当光束通过下列物质时,能观察到丁
达尔效应的是__ __(填序号)。
①氯化铁溶液 ② Fe(OH)3 胶体
(3)向盛有氢氧化铝悬浊液的试管中滴加氢氧化钠溶液,得到无色透明溶液,该反应的离子方
程式为 。
铝、铁、铜是人类生活和生产中具有广泛应用的三种金属单质,高中段的学习常把它们及化合物归结为重要的三角关系:
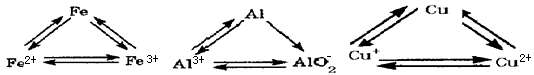
请回答下列问题
(1)氮化铝是一种性能良好的高温结构陶瓷,它的电子式:_________; 铁在周期表中的位置:_____________;
(2)铜生成铜绿是生活中常见的现象,其反应原理用方程式表示:_________; 氢氧化铝被称为两性氢氧化物,写出其酸式电离方程式:__________________;
(3)高铁酸盐被科学家们公认为绿色消毒剂, 它可以通过如下途径制备:次氯酸盐氧化法制备:采用次氯酸盐氧化法,在10.00 mL质量分数为8%的次氯酸钠溶液中加入5.5 g氢氧化钠和0.70 g硫酸铁,可制备摩尔浓度(物质的量浓度)为0.01 mol/L的高铁酸钠,写出制备的离子方程式: __________________高铁酸钠不仅可以消毒,也可以作净水剂,陈述理由:__________________
(4)燃料电池如图所示,写出石墨(I)电极上发生的电极反式:__________________ 。以此燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4 溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为_____________.。
(1)氮化铝是一种性能良好的高温结构陶瓷,它的电子式:_________; 铁在周期表中的位置:_____________;
(2)铜生成铜绿是生活中常见的现象,其反应原理用方程式表示:_________; 氢氧化铝被称为两性氢氧化物,写出其酸式电离方程式:__________________;
(3)高铁酸盐被科学家们公认为绿色消毒剂, 它可以通过如下途径制备:次氯酸盐氧化法制备:采用次氯酸盐氧化法,在10.00 mL质量分数为8%的次氯酸钠溶液中加入5.5 g氢氧化钠和0.70 g硫酸铁,可制备摩尔浓度(物质的量浓度)为0.01 mol/L的高铁酸钠,写出制备的离子方程式: __________________高铁酸钠不仅可以消毒,也可以作净水剂,陈述理由:__________________
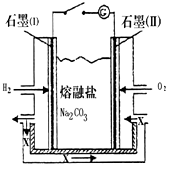
(4)燃料电池如图所示,写出石墨(I)电极上发生的电极反式:__________________ 。以此燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4 溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为_____________.。
(5)某研究性学习小组为探究铜、锌与浓盐酸反应,设计实验探究方案如下:实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化铜溶液实验记录:

背景资料:

某同学对实验中的白色沉淀进行分析,利用资料卡片资料①②大胆猜想,白色沉淀可能是CuCl。请你帮他设计验证方案。
