摘要:下列各种烟气均对大气有严重的污染: ① 硫酸工业尾气 ② 硝酸工业尾气 ③ 煅烧石灰石产生的气体 ④炼钢炉中产生的棕色烟气 ⑤焦炉煤气 ⑥高炉煤气.为了保护环境.其中经净化处理后.可用作气体燃料的是 A ①②④ B ①③⑤ C ③④⑤ D ④⑤⑥
网址:http://m.1010jiajiao.com/timu3_id_6213[举报]
33、有A,B,R三种元素,在空气中A元素的单质约占总体积的21%,B元素与A元素组成的氧化物在通常情况下为无色无味的液体,R元素的单质能在A元素的单质中燃烧,发出蓝紫色火焰,生成一种对大气有污染的气体D.请回答下列问题:
(1)A的元素符号为
(2)D 化学式为
查看习题详情和答案>>
(1)A的元素符号为
O
,B的元素名称为氢
,(2)D 化学式为
SO2
.(2008?徐汇区一模)有A、B、R三种元素,在空气中A的单质约占总体积的21%,B元素能与A元素组成相对分子质量最小的氧化物,该氧化物在常温下常压下为无色无味的液体,R元素的单质能在A元素的单质中燃烧,发出蓝紫色火焰,生成一种对大气有污染的气体D.请回答下列问题:
(1)A的元素符号为
(2)写出单质R在单质A中燃烧的化学方程式
查看习题详情和答案>>
(1)A的元素符号为
O
O
,B元素的氧化物化学式为H2O
H2O
;(2)写出单质R在单质A中燃烧的化学方程式
S+O2
SO2
| ||
S+O2
SO2
,该反应的基本反应类型是
| ||
化合反应
化合反应
.25、有A、B、R三种元素,在空气中A的单质约占总体积的21%,B元素能与A元素组成相对分子质量最小的氧化物,该氧化物在常温下常压下为无色无味的液体,R元素的单质能在A元素的单质中燃烧,发出蓝紫色火焰,生成一种对大气有污染的气体D.
请回答下列问题:
(1)A的元素符号为
(2)D的化学式为
查看习题详情和答案>>
请回答下列问题:
(1)A的元素符号为
O
,B的名称为氢
;(2)D的化学式为
SO2
,其中R元素的化合价为+4
.有A、B、R三种元素,在空气中A的单质约占总体积的21%,B元素能与A元素组成相对分子质量最小的氧化物,该氧化物在常温下常压下为无色无味的液体,R元素的单质能在A元素的单质中燃烧,发出蓝紫色火焰,生成一种对大气有污染的气体D.
请回答下列问题:
(1)B元素的名称为
(2)D的化学式为
(3)写出铁丝在单质A中燃烧的化学式表达式
查看习题详情和答案>>
请回答下列问题:
(1)B元素的名称为
氢
氢
;(2)D的化学式为
SO2
SO2
,其中R元素的化合价为+4
+4
.(3)写出铁丝在单质A中燃烧的化学式表达式
3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
.
| ||
聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,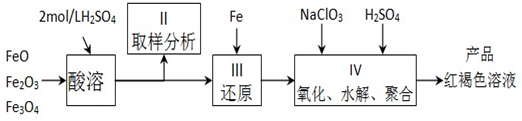
原料中的Fe3+必须先还原为Fe2+.实验步骤如下:
(1)用18mol/L的硫酸精确配制500ml 2mol/L的硫酸,所需的玻璃仪器除烧杯、量筒外,还需要
(2)步骤 II取样分析溶液中的Fe2+、Fe3+的含量,目的是
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4+NaClO3+3H2SO4═3Fe2(SO4)3+NaCl+3H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用稀HNO3代替NaClO3作氧化剂的利弊(假设HNO3还原产物只有NO),利是
(4)聚合硫酸铁溶液中SO42?与Fe3+物质的量之比不是3:2,根据下列提供的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42?与Fe3+物质的量之比.
①测定时所需的试剂
(a) NaOH(b) FeSO4(c) BaCl2(d) NaClO3
②需要测定
③选出测定过程中所需的基本操作
(a) 萃取、分液(b) 过滤、洗涤(c) 蒸发、结晶 (d) 冷却、称量(e)烘干.
查看习题详情和答案>>

原料中的Fe3+必须先还原为Fe2+.实验步骤如下:
(1)用18mol/L的硫酸精确配制500ml 2mol/L的硫酸,所需的玻璃仪器除烧杯、量筒外,还需要
玻璃棒;500ml容量瓶;胶头滴管
玻璃棒;500ml容量瓶;胶头滴管
(2)步骤 II取样分析溶液中的Fe2+、Fe3+的含量,目的是
bc
bc
.(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:6FeSO4+NaClO3+3H2SO4═3Fe2(SO4)3+NaCl+3H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用稀HNO3代替NaClO3作氧化剂的利弊(假设HNO3还原产物只有NO),利是
原料成本低
原料成本低
,弊是产生的气体对大气有污染
产生的气体对大气有污染
(可不填满)(4)聚合硫酸铁溶液中SO42?与Fe3+物质的量之比不是3:2,根据下列提供的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42?与Fe3+物质的量之比.
①测定时所需的试剂
ac
ac
.(a) NaOH(b) FeSO4(c) BaCl2(d) NaClO3
②需要测定
Fe2O3
Fe2O3
和BaSO4
BaSO4
的质量(填写化合物的化学式).③选出测定过程中所需的基本操作
bed
bed
(按操作先后顺序列出).(a) 萃取、分液(b) 过滤、洗涤(c) 蒸发、结晶 (d) 冷却、称量(e)烘干.