摘要:50.铜片与浓硝酸反应:反应激烈.有红棕色气体产生.
网址:http://m.1010jiajiao.com/timu3_id_62007[举报]
 如图为铜片与浓硝酸反应的装置示意图,据图回答下列问题:
如图为铜片与浓硝酸反应的装置示意图,据图回答下列问题:(1)写出试管内发生反应的化学方程式
Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3 (浓)=Cu(NO3)2+2NO2↑+2H2O
;(2)描述在实验过程中观察到的颜色变化:
试管内液体呈
绿
绿
色;试管内液体上方气体呈红棕
红棕
色;集气瓶内收集到的气体呈无
无
色.(3)在反应一段时间后,从分液漏斗处向试管内加入蒸馏水,请描述加水后试管内和集气瓶内颜色的变化情况:试管内液体呈
蓝
蓝
色;试管内液体上方气体呈无(或红棕色变浅)
无(或红棕色变浅)
色.
装置Ⅰ和装置Ⅱ、装置Ⅲ是有关硝酸和铜反应的实验装置示意图:
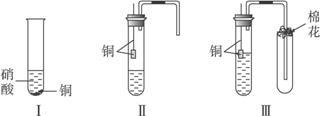
(1)若用装置Ⅰ进行铜与浓硝酸反应的实验,最大的缺点是__________________________;若用装置Ⅰ来证明铜与稀硝酸反应生成NO气体,其最大缺点是不能与浓硝酸跟铜反应形成鲜明对照效果。简述原因____________________________________________________________。
(2)若用装置Ⅱ进行适当操作,即可克服上述缺点,还能使上述两反应在同一试管中先后连续进行。实验步骤如下:
步骤一:组装好装置并______________后,加入2 mL浓硝酸(铜片接近酸液),塞紧胶塞。
步骤二:______________(操作)使反应发生。当导管口有少量红棕色气体逸出时,______________(操作使反应停止)。同时将导管插入水中。稍后能观察到:a.水沿导管倒吸至试管中;还可能观察到下列______________(填序号)等明显现象:b.溶液由蓝色变为无色;c.铜片表面产生气泡;d.红棕色气体变为无色。请解释产生现象a的原因___________________。
步骤三:当试管中溶液体积约占试管容积![]() 时,此时铜片与溶液接触,从水中抽出导管,并伸入一试管中,管口塞上浸有浓碱液的棉花(如装置Ⅲ)。这样做的目的是______________和______________。
时,此时铜片与溶液接触,从水中抽出导管,并伸入一试管中,管口塞上浸有浓碱液的棉花(如装置Ⅲ)。这样做的目的是______________和______________。
步骤四:反应完毕后,……
(3)上述实验“步骤四”中反应完毕后还需要进行的操作是_____________________________。
查看习题详情和答案>>