摘要:19.将Cl2通入无色KI溶液中.溶液中有褐色的物质产生.
网址:http://m.1010jiajiao.com/timu3_id_61978[举报]
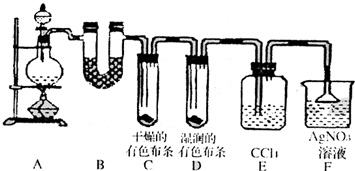 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.(1)下列方法中,可制得氯气的正确组合是
D
D
.①MnO2和浓盐酸混合共热②MnO2、NaCl和浓硫酸混合共热
③次氯酸钠和浓盐酸混合④K2Cr2O7和浓盐酸混合
⑤KClO3和浓盐酸混合共热⑥KMnO4和浓盐酸混合
A.①②⑥;B.②④⑥;C.①④⑥;D.全部可以
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是
加热时浓盐酸因挥发而损失,随着反应的进行或挥发浓度变稀以后,将不再反应
加热时浓盐酸因挥发而损失,随着反应的进行或挥发浓度变稀以后,将不再反应
(3)①装置B的作用是
证明有水蒸气产生
证明有水蒸气产生
,现象是白色固体变蓝色
白色固体变蓝色
.②装置C和D出现的不同现象说明的问题是
干燥氯气无漂白性,次氯酸有漂白性
干燥氯气无漂白性,次氯酸有漂白性
.③装置E的作用是
吸收氯气
吸收氯气
.④写出装置F中发生反应的离子方程式
Ag-+Cl-═AgCl↓
Ag-+Cl-═AgCl↓
.(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在
E
E
与F
F
之间(填装置字母序号),装置中应放入湿润的淀粉KI试纸(或湿润的有色布条)
湿润的淀粉KI试纸(或湿润的有色布条)
.某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题:

(1)写出A中发生反应的化学方程式
(2)①装置B中盛放的试剂为
②装置D和E中出现的不同现象说明的问题是
③写出装置G中发生反应的离子方程式
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在
(4)丙同学将4.48L氯气(标准状况下测定)通入到足量的石灰乳中,理论上可制得氧化产物质量
查看习题详情和答案>>

(1)写出A中发生反应的化学方程式
4HCl(浓)十Mn02
MnCl2+C12↑+2H2O
| ||
4HCl(浓)十Mn02
MnCl2+C12↑+2H2O
.
| ||
(2)①装置B中盛放的试剂为
无水硫酸铜
无水硫酸铜
,作用是证明有水蒸气产生
证明有水蒸气产生
.②装置D和E中出现的不同现象说明的问题是
氯气无漂白性,次氯酸有漂白性
氯气无漂白性,次氯酸有漂白性
.③写出装置G中发生反应的离子方程式
Ag++Cl-=AgCl↓
Ag++Cl-=AgCl↓
.(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在
F
F
和G
G
之间(填两个装置字母序号),装置中应放入湿润的淀粉KI试纸(或湿润的有色布条)
湿润的淀粉KI试纸(或湿润的有色布条)
(填写试剂或用品名称).(4)丙同学将4.48L氯气(标准状况下测定)通入到足量的石灰乳中,理论上可制得氧化产物质量
14.3
14.3
g.FeBr2溶液与氯气的反应中,Cl2既可氧化Br-为Br2,也可氧化Fe2+为Fe3+.Cl2氧化Br-与Fe2+是否有先后顺序呢?某学习小组做如下探究:
(1)配制100mL0.10mol?L-1FeBr2溶液:
①用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管、______.
②溶解FeBr2固体时,用稀的HBr溶液而不用蒸馏水的原因是______.
(2)向足量0.10mol?L-1 FeBr2溶液中通入少量的Cl2后,溶液变为黄色.
(3)提出合理假设:
假设1:有先后顺序,Cl2先氧化Br-,生成Br2使溶液显黄色
假设2:有先后顺序,Cl2先氧化Fe2+,生成Fe3+使溶液显黄色
假设3:无先后顺序,______
(4)实验探究:完成实验步骤及预期现象与结论.
[限选试剂:0.10mol?L-1AgNO3溶液、淀粉-KI溶液、10%KSCN溶液、四氯化碳、稀HNO3]
| 实验操作 | 预期现象与结论 |
| 步骤1:将所得黄色溶液分别取少许于 A、B两个试管中. | |
| 步骤2:______ | ______ |
| 步骤3:______ | ______ |
复分解反应和氧化还原反应都是重要的反应类型.回答下列问题:
(1)“盐+酸→新盐+新酸”是复分解反应中的一种类型.在Na2SiO3溶液中滴入盐酸,生成的新酸是________(写化学式).
(2)硫化铝投入水中发生反应:Al2S3+6H2O![]() 2Al(OH)3↓+3H2S↑,该反应________(填“属于”或“不属于”)复分解反应.
2Al(OH)3↓+3H2S↑,该反应________(填“属于”或“不属于”)复分解反应.
(3)Ca(HCO3)2与Ca(OH)2反应属于复分解反应,写出反应的化学方程式________;
(4)工业上可用氨与Cl2反应检验输送氯气的管道是否漏气,反应方程式如下:8NH3+3Cl2![]() 6NH4Cl+N2.
6NH4Cl+N2.
①请在上述方程式中表示出电子转移的方向和数目.
②该反应中,________是还原剂;若反应中有1.5 mol氧化剂参与反应,则发生转移的电子的物质的量为________mol,被氧化的物质有________mol.
(5)若将Cl2通入KI溶液中会发现无色溶液变成棕黄色后又褪色.这是因为发生如下2个反应:
①________;
②I2+Cl2+H2O![]() HIO3+________(不必配平).
HIO3+________(不必配平).
已知:E为常见金属单质,C、D、F、I均为常见气体,其中C、D为单质,F、I为化合物,且组成元素相同,D、F有毒,I为直线型非极性分子,它们有如下框图关系: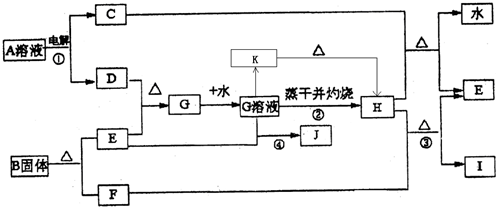
(1)反应①阳极的电极反应式
(2)反应③的化学方程式
(3)反应④的离子方程式为
(4)K是一种难溶于水的固体,K受热分解可生成H.实现由G溶液到K的转化时可以加入的试剂是(填写选项字母)
A.NaOH溶液 B.氨水 C.Na2CO3溶液 D.NaHCO3溶液
(5)将G的饱和溶液加入到沸水中,继续加热可得红褐色液体,写出反应的离子方程式:
(6)若E中含有合金元素,会导致G不纯.测定G的质量分数通常可用碘量法测定:称取mg无水G样品,溶于稀盐酸,再转移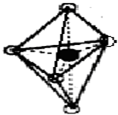 到
到
100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol?L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去VmL.(杂质不参与反应)则样品中G的质量分数为:
×%
×%.
(7)B的结构为三角双锥(如图所示),图中○代表F分子,●代表E原子.则B的化学式为
查看习题详情和答案>>

(1)反应①阳极的电极反应式
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
.(2)反应③的化学方程式
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
(3)反应④的离子方程式为
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.(4)K是一种难溶于水的固体,K受热分解可生成H.实现由G溶液到K的转化时可以加入的试剂是(填写选项字母)
ABCD
ABCD
A.NaOH溶液 B.氨水 C.Na2CO3溶液 D.NaHCO3溶液
(5)将G的饱和溶液加入到沸水中,继续加热可得红褐色液体,写出反应的离子方程式:
FeCl3+3H2O(沸水)=Fe(OH)3(胶体)+3HCl
FeCl3+3H2O(沸水)=Fe(OH)3(胶体)+3HCl
,该液体接通直流电后阴
阴
极附近颜色加深,这种过程叫做电泳
电泳
.(6)若E中含有合金元素,会导致G不纯.测定G的质量分数通常可用碘量法测定:称取mg无水G样品,溶于稀盐酸,再转移
 到
到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol?L-1Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去VmL.(杂质不参与反应)则样品中G的质量分数为:
| 162.5Vc |
| m |
| 162.5Vc |
| m |
(7)B的结构为三角双锥(如图所示),图中○代表F分子,●代表E原子.则B的化学式为
Fe(CO)5或者FeC5O5
Fe(CO)5或者FeC5O5
.