摘要:20mL物质的量浓度为18mol/L的硫酸中加入足量铜片并加热.充分反应.下列有关说法中正确的是( ) A.有0.18mol的硫酸被还原 B.标准状况下.还原产物的体积约为4L C.充分反应后体系无硫酸剩余 D.反应消耗的铜的质量一定少于11.52g
网址:http://m.1010jiajiao.com/timu3_id_61643[举报]
(2009?金华模拟)分别取等物质的量浓度的氢氧化钠溶液各100mL,再通入一定量的CO2,随后分别各取20mL溶液,向其中逐滴滴入0.2mol/L的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B两种情况):
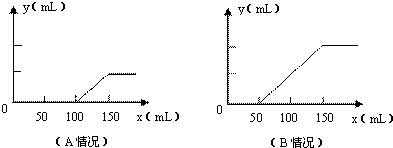
(1)在A情况下,溶质是(填化学式)
(2)在B情况下,溶质是(填化学式)
(3)原氢氧化钠溶液的物质的量浓度为
查看习题详情和答案>>

(1)在A情况下,溶质是(填化学式)
NaOH、Na2CO3
NaOH、Na2CO3
,其物质的量之比为1:1
1:1
.(2)在B情况下,溶质是(填化学式)
Na2CO3、NaHCO3
Na2CO3、NaHCO3
,其物质的量之比为1:1
1:1
.(3)原氢氧化钠溶液的物质的量浓度为
1.5mol?L-1
1.5mol?L-1
. 实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题
实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题(1)所需仪器为容量瓶的规格为
500mL
500mL
使用容量瓶前必须进行的操作是检验容量瓶是否漏水
检验容量瓶是否漏水
.(2)试分析下列操作对所配溶液的浓度有何影响.
①为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至容量瓶定容.对所配溶液浓度的影响:
偏高
偏高
②定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度.对所配溶液浓度的影响
偏低
偏低
.③某同学观察液面的情况如图所示,则所配置的溶液的浓度偏
偏高
偏高
.(3)从该溶液中取出50ml,其中NaCl的物质的量浓度为
1.00mol/L
1.00mol/L
,将取出的50ml溶液加水稀释到100ml,稀释后溶液中NaCl的物质的量浓度为0.50mol/L
0.50mol/L
. 将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:(1)下列说法正确的是
BD
BD
.A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
(2)在相同时间内,两烧杯中产生气泡的速度:甲
>
>
乙(填“>”、“<“或“=”).(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为
6.02×1022
6.02×1022
.(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中c(H+)=0.1mol?L-1(设反应前后溶液体积不变).试确定原稀硫酸的物质的量浓度为
1 mol?L-1
1 mol?L-1
. 如图是某盐酸试剂瓶标签的部分内容.据此判定下列说法正确的是( )
如图是某盐酸试剂瓶标签的部分内容.据此判定下列说法正确的是( )