摘要:(1).向银氨溶液中加入NaCl溶液.无白色沉淀生成.加入KI 溶液有黄色沉淀生成.说明银氨溶液中 离子浓度很小.但加入盐酸后立即产生白色沉淀.写出反应离子方程式 . (2).现有一包白色固体.可能由A: (NH4)2 SO4.B:AL2(SO4)3,C:NaCI,D:AgNO3,E: KOH,F: KI,G:BaCI2中的一种或几种组成.该白色固体溶于水的较稀澄清溶液.该溶液能使酚肽呈红色.若在该溶液中加适量稀硝酸.有白色沉淀生成.回答下列问题: ①.该白色固体中一定不存在的化合物有 ②.该白色固体中至少存在哪几种化合物?请写出可能情况 一种情况 .另一种情况 .
网址:http://m.1010jiajiao.com/timu3_id_60897[举报]
 某课外活动小组对甲酸进行了如下的实验,以验证其含有醛基,并考察其化学性质.首先做了银镜反应:
某课外活动小组对甲酸进行了如下的实验,以验证其含有醛基,并考察其化学性质.首先做了银镜反应:(1)取少量甲酸加入NaOH溶液中和其酸性,反应的离子方程式为
HCOOH+OH-→HCOO-+H2O
HCOOH+OH-→HCOO-+H2O
.(2)在(1)的溶液中加入银氨溶液,加热,产生了光亮银镜,该小组同学很成功的做了银镜反应,他肯定没有进行的操作
BCD
BCD
(写字母):A、用洁净的试管
B、向银氨溶液中加入硝酸酸化
C、用前几天配制好的银氨溶液
D、在浓度为2%的NH3?H2O中滴入稍过量的浓度为2%的硝酸银
然后,同学们对甲酸与乙醇的酯化反应进行了研究,按下图装置进行实验:
(3)写出
 和CH3CH2-18OH进行酯化反应的化学方程式
和CH3CH2-18OH进行酯化反应的化学方程式HCOOH+CH3CH218OH
HCO18OCH2CH3+H2O
| 浓H2SO4 |
| 加热 |
HCOOH+CH3CH218OH
HCO18OCH2CH3+H2O
.| 浓H2SO4 |
| 加热 |
(4)实验中饱和碳酸钠溶液的作用是
吸收乙酸,溶解乙醇,降低甲酸乙酯溶解度,有利于分层
吸收乙酸,溶解乙醇,降低甲酸乙酯溶解度,有利于分层
.从饱和碳酸钠溶液中分离出酯需要用到的主要实验仪器是分液漏斗
分液漏斗
.(5)一同学用装有饱和氢氧化钠的试管接收甲酸乙酯,几乎没有收集到产物,请给予合理的解释
甲酸乙酯在NaOH溶液中发生较彻底的水解
甲酸乙酯在NaOH溶液中发生较彻底的水解
.(2013?东城区二模)根据Fe3++Ag?Fe2++Ag+,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去.
(1)FeCl3溶液显酸性,原因是
(2)关于FeCl3溶液洗银后的相关叙述正确的是
a.c(Fe3+)减小 b. c(Cl-)不变 c.铁元素质量减小
(3)Fe(NO3)3溶液洗银时,甲同学认为NO3-也能将银氧化.他认为可以通过检验Fe(NO3)3溶液洗银后NO3-的还原产物来判断NO3-是否能将银氧化,而乙同学认为此方法不
(4)乙同学欲从洗银废液(Fe3+、Fe2+、Ag+、NO3-)中回收银和刻蚀液,设计了如下路线:
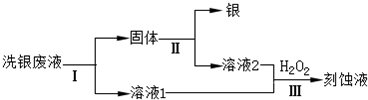
①过程Ⅰ中反应的离子方程式是
②过程Ⅱ中加入的试剂可以是
(5)镀银后的银氨溶液放置时会析出有强爆炸性的物质,所以不能贮存.从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.
①生成AgCl沉淀的化学方程式是
②若该反应中消耗3.3g羟氨,理论上可得银的质量为
查看习题详情和答案>>
(1)FeCl3溶液显酸性,原因是
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
(用离子方程式表示).(2)关于FeCl3溶液洗银后的相关叙述正确的是
a
a
(填序号).a.c(Fe3+)减小 b. c(Cl-)不变 c.铁元素质量减小
(3)Fe(NO3)3溶液洗银时,甲同学认为NO3-也能将银氧化.他认为可以通过检验Fe(NO3)3溶液洗银后NO3-的还原产物来判断NO3-是否能将银氧化,而乙同学认为此方法不
此空删掉
此空删掉
可行,乙同学的理由是酸性条件下NO3-也可能与Fe2+发生氧化还原反应
酸性条件下NO3-也可能与Fe2+发生氧化还原反应
.(4)乙同学欲从洗银废液(Fe3+、Fe2+、Ag+、NO3-)中回收银和刻蚀液,设计了如下路线:

①过程Ⅰ中反应的离子方程式是
2Fe3++Fe=3Fe2+Fe+2Ag+=Fe2++2Ag
2Fe3++Fe=3Fe2+Fe+2Ag+=Fe2++2Ag
.②过程Ⅱ中加入的试剂可以是
稀盐酸或稀硫酸
稀盐酸或稀硫酸
.(5)镀银后的银氨溶液放置时会析出有强爆炸性的物质,所以不能贮存.从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.
①生成AgCl沉淀的化学方程式是
Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O
Ag(NH3)2OH+3HCl=AgCl↓+2NH4Cl+H2O
.②若该反应中消耗3.3g羟氨,理论上可得银的质量为
10.8
10.8
g.根据Fe3++ Ag  Fe2+
+ Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
Fe2+
+ Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
(1)FeCl3溶液显酸性,原因是 (用离子方程式表示)。
(2)关于FeCl3溶液洗银后的相关叙述正确的是 (填序号)。
a.c(Fe3+)减小 b.c(Cl-)不变 c.铁元素质量减小
(3)Fe(NO3)3溶液洗银时,甲同学认为NO3-也能将银氧化。他认为可以通过检验Fe(NO3)3溶液洗银后NO3-的还原产物来判断NO3-是否能将银氧化,而乙同学认为此方法不 可行,乙同学的理由是 。
(4)乙同学欲从洗银废液(Fe3+、 Fe2+、 Ag+、 NO3-)中回收银和刻蚀液,设计了如下路线:
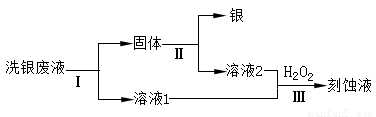
①过程Ⅰ中反应的离子方程式是 。
②过程Ⅱ中加入的试剂可以是 。
(5)镀银后的银氨溶液放置时会析出有强爆炸性的物质,所以不能贮存。从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①生成AgCl沉淀的化学方程式是 。
②若该反应中消耗3.3 g羟氨,理论上可得银的质量为 g。
查看习题详情和答案>>