网址:http://m.1010jiajiao.com/timu3_id_60715[举报]
Ⅰ.可选用的药品有:a.石灰石b.饱和氯化钙溶液c.6mol/L盐酸d.氯化铵e.氢氧化钙.

(1)A中制备气体时,所需药品是(选填字母序号)
(2)B中盛有饱和碳酸氢钠溶液,其作用是
(3)写出制取氨气的化学方程式
| ||
| ||
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式
(5)检验D出口处是否有氨气逸出的方法是
(6)写出制纳米级碳酸钙的化学方程式
(7)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级
(8)若实验过程中有氨气逸出,应选用图2中
Ⅱ.经分析在上述氯化铵样品中含有杂质碳酸氢钠.为了测定氯化铵的质量分数,该学生实验小组又设计了如图3所示实验流程:
试回答:
(1)所加试剂A的化学式为
(2)B操作方法是
(3)样品中氯化铵的质量分数为
W1-
| ||
| W1 |
W1-
| ||
| W1 |
W1-
| ||
| W1 |
W1-
| ||
| W1 |
工业制纯碱的第一点是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,此反应是放热反应。
NH3+CO2+H2O+NaCl(饱和)=== NaHCO3(晶体)↓+NH4Cl
(1)某校学生实验小组利用上述反应原理,设计如图1所示装置,制取碳酸氢钠晶可选用的药品有: a.石灰石b.生石灰c.6mol/L盐酸d.稀硫酸e.浓氨水f.饱和氯化钠溶液。
①A中制备气体时,所需药品是(选填字母代号) ;
②B中盛有饱和碳酸氢钠溶液,其作用是 ;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为
④检验D出口处是否有氨气逸出的方法是 。
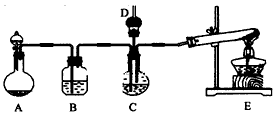
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行如图2所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是(选填字母序号)
;
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作Ⅲ的方法为 、 、 ;
③所得晶体中碳酸氢钠的纯度为 。
查看习题详情和答案>>工业制纯碱的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,制取碳酸氢钠晶体。该反应原理可以用以下化学方程式表示,此反应是放热反应。
NH3 + CO2 + H2O + NaCl(饱和) ![]() NaHCO3(晶体)↓+ NH4Cl
NaHCO3(晶体)↓+ NH4Cl
(1)某校学生实验小组利用上述反应原理,设计如图所示装置,制取碳酸氢钠晶体。C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
可选用的药品有:a.石灰石 b.生石灰 c.6 mol/L盐酸 d.稀硫酸 e.浓氨水
f.饱和氯化钠溶液。

①A中制备气体时,所需药品是(选填字母代号) ;
②B中盛有饱和碳酸氢钠溶液,其作用是 ;
③在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式为 ;
④检验D出口处是否有氨气逸出的方法是 。
(2)该小组同学为了测定C中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为wg。再将晶体加热到质量不再变化时,称量所得粉末质量为mg。然后进行如图所示实验:

①在操作II中,为了判断加入氯化钙溶液是否过量,其中正确的是(选填字母序号) ;
A.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
B.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
C.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②操作III的方法为 、 、 ;
③所得晶体中碳酸氢钠的纯度为 。
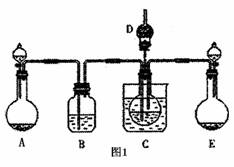
查看习题详情和答案>>纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业.在浓CaCl2溶液中通入NH3和C02,可以制得纳米级碳酸钙.某校学生实验小组设计下图所示装置,制取该产品.D中装有蘸稀硫酸的脱脂棉,图1中夹持装置已略去.
Ⅰ.可选用的药品有:a.石灰石b.饱和氯化钙溶液c.6mol/L盐酸d.氯化铵e.氢氧化钙.

(1)A中制备气体时,所需药品是(选填字母序号)______;
(2)B中盛有饱和碳酸氢钠溶液,其作用是______;
(3)写出制取氨气的化学方程式______;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式______;
(5)检验D出口处是否有氨气逸出的方法是______;
(6)写出制纳米级碳酸钙的化学方程式______.
(7)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级______.
(8)若实验过程中有氨气逸出,应选用图2中______装置回收(填代号).
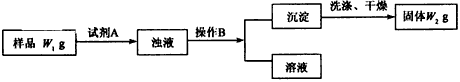
Ⅱ.经分析在上述氯化铵样品中含有杂质碳酸氢钠.为了测定氯化铵的质量分数,该学生实验小组又设计了如图3所示实验流程:
试回答:
(1)所加试剂A的化学式为______检验所加试剂A已经过量的方法是______.
(2)B操作方法是______洗涤沉淀的方法是______.
(3)样品中氯化铵的质量分数为______.
查看习题详情和答案>>
CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计如图所示装置,制取该产品。D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
Ⅰ.可选用的药品有:a.石灰石 b.饱和氯化钙溶液 c.6 mol/L盐酸 d.氯化铵 e.氢氧化钙。
(2)B中盛有饱和碳酸氢钠溶液,其作用是________________;
(3)写出制取氨气的化学方程式:____________________;
(4)在实验过程中,向C中通入气体式有先后顺序的,应先通入气体的化学式:___________________;
(5)检验D出口处是否有氨气逸出的方法是________________;
(6)写出制纳米级碳酸钙的化学方程式:____________________;
(7)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级_______________
(8)若实验过程中有氨气逸出,应选用下列____装置回收(填代号)。

(9)所加试剂A的化学式为________,检验所加试剂A已经过量的方法是____________。
(10)B操作方法是________,洗涤沉淀的方法是________。
(11)样品中氯化铵的质量分数为________。