摘要:Ⅰ⑴不完全.,CO2+C高温2CO 或 CuO+C高温Cu+CO↑ , ⑵ 7.4g. Ⅱ.⑴ 解:依题意.m g X中:n(Cu)∶n(Fe)=1∶1 2n(Cu2+) +3n(Fe3+) =6.05mol·L-1×0.2L×2-1 mol·L-1×2.12L 故:n (Cu) = n (Fe) = 0.06mol 又.n (S) = 0.6mol·L-1×0.1L×2 = 0.12mol 因此.m g = m(Cu) + m(Fe) + m(S) = 0.06mol×64g·mol-1+0.06mol×56g·mol-1+0.12mol×32g·mol-1= 11.04g 即m 的值为11.04 ⑵ 解:设X的化学式为(CuFeS2)n.则 ×n = 368 n = 2故X的化学式为Cu2Fe2S4
网址:http://m.1010jiajiao.com/timu3_id_60278[举报]
由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4
Ti已知:
①
②
③
则(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=
(2)碳在氧气中不完全燃烧生成CO的热化学方程式为
查看习题详情和答案>>
| ||
| 800℃.Al |
①
|
②
|
③
|
则(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=
-80KJ/mol
-80KJ/mol
.(2)碳在氧气中不完全燃烧生成CO的热化学方程式为
2C(s)+O2(g)═2CO(g);△H=-221kJ/mol或C(s)+
O2(g)═CO(g);△H=-110.5kJ/mol
| 1 |
| 2 |
2C(s)+O2(g)═2CO(g);△H=-221kJ/mol或C(s)+
O2(g)═CO(g);△H=-110.5kJ/mol
.| 1 |
| 2 |
盖斯定律可用于难于测定反应的反应热的计算,已知C的燃烧热为Q1KJ?mol-1,CO的燃烧热为Q2 KJ?mol-1,写出C不完全燃烧生成CO的热化学方程式.
查看习题详情和答案>>
C(s)+
O2(g)=CO△H=Q2-Q1kJ/mol
| 1 |
| 2 |
C(s)+
O2(g)=CO△H=Q2-Q1kJ/mol
.| 1 |
| 2 |
 碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.
碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.(1)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145KJ热量,写出该反应的热化学方程式
2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)△H=-290.0kJ?mol-1
2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)△H=-290.0kJ?mol-1
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与CO2反应生成甲醇.已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8KJ/mol-1、283.0kJ?mol-1和726.5kJ?mol-1.则:①利用太阳能分解10mol水消耗的能量是
2858
2858
kJ.②甲醇不完全燃烧生成CO和液态水的热化学方程式为
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ?mol-1
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ?mol-1
(3)某反应的反应过程中能量变化如图 所示(图中E1 表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是
ACD
ACD
A.该反应为吸热热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能小于正反应的活化能.
利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4的产量随光照时间的变化如图1所示.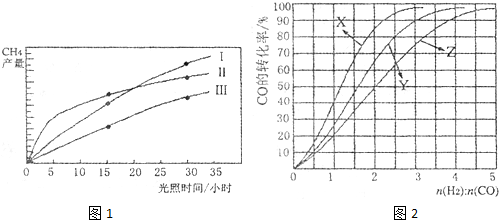
(1)在O?30小时内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)由大到小的顺序为 ;反应开始后的15小时内,在第 种催化剂的作用下,收集的CH4最多.
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ.mol-1.将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10mol,CH4的平衡转化率为91%,则此温度下该反应的平衡常数为 (计算结果取整数).
(3)该反应产生的CO和H2可用来合成可再生能源甲醇,已知CO(g)、CH3OH(l)的燃烧热△H分别为-283.0kJ?mol-1和-726.5kJ?mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 .
(4)工业上常利用反应CO(g)+2H2(g)?CH3OH(g),△H<0合成甲醇,在230℃?270℃最为有利.为研究合成气最合适的起始组成比n(H2):n(CO),分别在230℃、250℃和270℃进行实验,结果如图2.
①270℃的实验结果所对应的曲线是 (填字母);
②230℃时,工业生产适宜釆用的合成气组成n(H2):n(CO)的比值范围是 (填字母).
A.1?1.5 B.2.5?3 C.3.5?4.5
(5)某同学以石墨为电极,以KOH溶液为电解质设计甲醇燃料电池,其负极的电极反应式为 .
查看习题详情和答案>>

(1)在O?30小时内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)由大到小的顺序为
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ.mol-1.将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10mol,CH4的平衡转化率为91%,则此温度下该反应的平衡常数为
(3)该反应产生的CO和H2可用来合成可再生能源甲醇,已知CO(g)、CH3OH(l)的燃烧热△H分别为-283.0kJ?mol-1和-726.5kJ?mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为
(4)工业上常利用反应CO(g)+2H2(g)?CH3OH(g),△H<0合成甲醇,在230℃?270℃最为有利.为研究合成气最合适的起始组成比n(H2):n(CO),分别在230℃、250℃和270℃进行实验,结果如图2.
①270℃的实验结果所对应的曲线是
②230℃时,工业生产适宜釆用的合成气组成n(H2):n(CO)的比值范围是
A.1?1.5 B.2.5?3 C.3.5?4.5
(5)某同学以石墨为电极,以KOH溶液为电解质设计甲醇燃料电池,其负极的电极反应式为
(6分)(1)1.00L1.00mol/LH2SO4溶液与2.00L1.00mol/LNaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为 。
(2)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
已知:①C(s) + O2(g) = CO2(g);ΔH=-393.5kJ/mol
②2CO(g) + O2(g) = 2CO2(g);ΔH=-566kJ/mol
③TiO2(s) + 2Cl2(g) = TiCl4(s)+O2(g);ΔH=+141kJ/mol
2Cl2(g) = TiCl4(s)+O2(g);ΔH=+141kJ/mol
则a.碳在氧气中不完全燃烧生成CO的热化学方程式为
。
b.TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(s) + 2CO(g)的ΔH=________________。