摘要:26.答案: (1)为了防止亚铁化合物被氧化. (2)CO2 H2O NH3. (3)Fe+H2PO4- +Li+-2e-LiFePO4↓+2H+. (4)+3NaOH+HOCH2CH2OH+Na2CO3 +CH3OH (5)FePO4+Li++e- LiFePO4 [思路](1)由亚铁的还原性可以想到选择惰性气氛的原因,(2)因为其他物质为气体.结合质量守恒进行配平可知有CO2.H2O.NH3生成.(3)由于阳极材料是Fe.又因该极生成LiFePO4可以该极的大体转化过程为“FeLiFePO4 .根据质量守恒可知还有H2PO4- 和Li+参加反应.从而完成电极反应的书写.(5)充电时.被充电池的正极与电源的正极相连.此时被充电池实为电解池.被充电池的正极即为电池解的阳极. [解析](1)根据题给信息.磷酸亚铁锂中存在的是Fe2+离子.很容易被空气中的O2氧化.故灼烧时需用惰性气体保护. (3)方法二中.阳极的电极反应包括Fe原子失去电子生成Fe2+.还有Fe2+与H2PO4- .Li+的沉淀反应. (4)M分子中含3个酯键.跟足量NaOH反应时.这3个酯键都会断裂. (5)可充电电池充电时.发生的反应是电池放电时的逆过程.据此原理.原电池放电时.正极是+3价铁得电子成为+2价铁.
网址:http://m.1010jiajiao.com/timu3_id_59942[举报]
(2009?四川)新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池.磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出.
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀.沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂.
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下: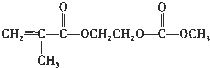
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行.其原因是
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
(4)写出M与足量氢氧化钠溶液反应的化学方程式:
 .
.
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
查看习题详情和答案>>
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出.
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀.沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂.
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
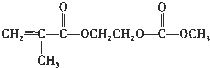
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行.其原因是
为了防止亚铁化合物被氧化
为了防止亚铁化合物被氧化
.(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有
CO2
CO2
、H2O
H2O
、NH3
NH3
(填化学式)生成.(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为
Fe+H2PO4-+Li+-2e-=LiFePO4+2H+
Fe+H2PO4-+Li+-2e-=LiFePO4+2H+
.(4)写出M与足量氢氧化钠溶液反应的化学方程式:


(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为
FePO4+Li++e-═LiFePO4
FePO4+Li++e-═LiFePO4
. 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.(1)检验矿物样品中是否有Fe3+
实验用品:锤子、研钵、烧杯、玻璃棒、漏斗、铁架台、滤纸、试管、胶头滴管
实验步骤:
①取样:将样品用锤子敲碎,再在研钵中研细备用.
②溶解:将样品粉末倒入烧杯,加入
稀盐酸
稀盐酸
,用玻璃棒充分搅拌.③
过滤
过滤
(填操作名称).④检验:取少许溶液,
滴加KSCN溶液
滴加KSCN溶液
.实验现象:
溶液变为红色
溶液变为红色
.实验结论:矿物样品中含有Fe3+.
(2)制备氢氧化亚铁
①为了得到亚铁盐的溶液,同学们在剩余的溶液中加入过量的某种固体试剂,该试剂是(填化学式)
Fe
Fe
,反应的离子方程式是2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.②对于①中过量的固体试剂是否需要除去,同学们产生了两种观点.
甲组:认为需要过滤. 乙组:认为不需要过滤.
你支持的是组
乙
乙
(填“甲”或“乙”),理由是过量的铁粉可以防止Fe2+被氧化为Fe3+
过量的铁粉可以防止Fe2+被氧化为Fe3+
③同学们在新制得的亚铁盐溶液中加入适量新制的氢氧化钠溶液,制出的氢氧化亚铁呈
白
白
色.为使试管中的氢氧化亚铁保存的时间更长,请在右图中画出你的设计(可以加必要的文字说明).有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
(1)检验矿物样品中是否有Fe3+
【实验用品】锤子、研钵、烧杯、玻璃棒、漏斗、铁架台、滤纸、试管、胶头滴管
【实验步骤】①取样:将样品用锤子敲碎,再在研钵中研细备用.
②溶解:将样品粉末倒入烧杯,加入 ,用玻璃棒充分搅拌.
③过滤.
④检验:取少许滤液于试管中,滴加 .实验现象: .
【实验结论】矿物样品中含有Fe3+.
(2)制备氢氧化亚铁
①为了得到亚铁盐的溶液,同学们在剩余的溶液中加入过量的某种固体试剂,该试剂是(填化学式) ,反应的离子方程式是 .
②同学们在新制得的亚铁盐溶液中加入不含O2的蒸溜水配制的NaOH溶液,制出的氢氧化亚铁.)其操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.要这样操作的理由是 .
写出氢氧化亚铁和氧气反应的化学方程式: .
查看习题详情和答案>>
(1)检验矿物样品中是否有Fe3+
【实验用品】锤子、研钵、烧杯、玻璃棒、漏斗、铁架台、滤纸、试管、胶头滴管
【实验步骤】①取样:将样品用锤子敲碎,再在研钵中研细备用.
②溶解:将样品粉末倒入烧杯,加入
③过滤.
④检验:取少许滤液于试管中,滴加
【实验结论】矿物样品中含有Fe3+.
(2)制备氢氧化亚铁
①为了得到亚铁盐的溶液,同学们在剩余的溶液中加入过量的某种固体试剂,该试剂是(填化学式)
②同学们在新制得的亚铁盐溶液中加入不含O2的蒸溜水配制的NaOH溶液,制出的氢氧化亚铁.)其操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.要这样操作的理由是
写出氢氧化亚铁和氧气反应的化学方程式:
人类生活离不开化学,硫酸亚铁、醋酸、小苏打、食盐、次氯酸钙、氢氧化铝都是生活中较常见的化学物质.
(1)医疗上常用
(2)治疗胃酸过多的药物主要成分是氢氧化铝或碳酸氢钠,请分别写出中和胃酸的离子方程式:
(3)生活中的食醋和淀粉溶液分别属于分散系中的溶液和
查看习题详情和答案>>
(1)医疗上常用
FeSO4
FeSO4
(从上述物质中选,填化学式)糖衣片治疗贫血病,外面包裹糖衣的目的是防止亚铁离子被氧化
防止亚铁离子被氧化
;(2)治疗胃酸过多的药物主要成分是氢氧化铝或碳酸氢钠,请分别写出中和胃酸的离子方程式:
Al(OH)3+3H+═Al3++3H2O
Al(OH)3+3H+═Al3++3H2O
、HCO3-+H+═H2O+CO2↑
HCO3-+H+═H2O+CO2↑
;(3)生活中的食醋和淀粉溶液分别属于分散系中的溶液和
胶体
胶体
,用丁达尔效应
丁达尔效应
可以鉴别(填化学专用名词).(2012?江苏三模)草酸合铁酸钾晶体Kx[Fe(C2O4)y]?3H2O可用于摄影和蓝色印刷.实验室制备草酸合铁酸钾晶体的实验流程如下:
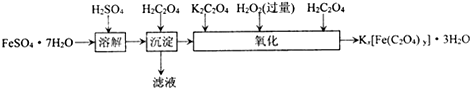
(1)若用铁和稀硫酸制备FeSO?7H2O,常保持
(2)上述流程中,“沉淀”一步所得Fe(C2O4)?2H2O沉淀需用水洗涤.检验沉淀是否洗涤干净的方法是
(3)测定草酸合铁酸钾产品中Fe3+含量和C2O
含量的实验步骤如下:
步骤1:准确称取所制草酸合铁酸钾晶体ag(约1.5g),配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入6mol?L-1HCl 10mol,加热至70~80℃,趁热用SnCl2-TiCl3联合还原法将Fe3+全部还原为Fe2+,加入MnSO4溶液10mL,在75~80℃下用0.01000mol?L-1 KMnO4标准溶液滴定至终点(Cl- 不参与反应),将C2O
全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积.
步骤3:…
步骤4:重复上述步骤2~步骤3两次.
①步骤2操作时,还需要如图所示的仪器中的
②步骤2中MnSO4溶液的作用是
③在不增加试剂种类的前提下,步骤3的目的是
查看习题详情和答案>>

(1)若用铁和稀硫酸制备FeSO?7H2O,常保持
铁
铁
过量,理由是防止亚铁离子被氧气氧化
防止亚铁离子被氧气氧化
.(2)上述流程中,“沉淀”一步所得Fe(C2O4)?2H2O沉淀需用水洗涤.检验沉淀是否洗涤干净的方法是
取少量最后一次洗涤液,加入氯化钡溶液,若出现白色沉淀,说明沉淀没有洗涤干净,若不出现白色沉淀,证明沉淀洗涤干净
取少量最后一次洗涤液,加入氯化钡溶液,若出现白色沉淀,说明沉淀没有洗涤干净,若不出现白色沉淀,证明沉淀洗涤干净
.(3)测定草酸合铁酸钾产品中Fe3+含量和C2O
2- 4 |

步骤1:准确称取所制草酸合铁酸钾晶体ag(约1.5g),配成250mL待测液.
步骤2:用移液管移取25.00mL待测液于锥形瓶中,加入6mol?L-1HCl 10mol,加热至70~80℃,趁热用SnCl2-TiCl3联合还原法将Fe3+全部还原为Fe2+,加入MnSO4溶液10mL,在75~80℃下用0.01000mol?L-1 KMnO4标准溶液滴定至终点(Cl- 不参与反应),将C2O
2- 4 |
步骤3:…
步骤4:重复上述步骤2~步骤3两次.
①步骤2操作时,还需要如图所示的仪器中的
ad
ad
(填序号).②步骤2中MnSO4溶液的作用是
作催化剂
作催化剂
,滴定终点的现象是溶液变为浅红色,且半分钟内部褪色
溶液变为浅红色,且半分钟内部褪色
.③在不增加试剂种类的前提下,步骤3的目的是
测定C2O42-的含量
测定C2O42-的含量
.