摘要:23.答案: (1)负极材料为Li.Li – e- = Li+. (2)2SOCl2+4e- = 4Cl-+S+SO2. (3)出现白雾.有刺激性气体生成, SOCl2+H2O = SO2↑+2HCl↑. (4)因为构成电池的两个主要成份Li能和氧气水反应.且SOCl2也与水反应. [解析](1)分析反应的化合价变化.可得Li为还原剂.失电子:Li-e- = Li+. (2)SOCl2为氧化剂.得电子.从题给电池反应可推出产物:Cl-+S+SO2.(或用总反应减去负极反应) (3)题中已给出信息:碱液吸收时的产物是Na2SO3和NaCl.则没有碱液吸收时的产物应为SO2和HCl.进而推出现象.
网址:http://m.1010jiajiao.com/timu3_id_59939[举报]
Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2
电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.请回答下列问题:
(1)电池的负极材料为
(2)电池正极发生的电极反应为
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,发生反应的化学方程式为
查看习题详情和答案>>
电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.请回答下列问题:
(1)电池的负极材料为
锂
锂
;(2)电池正极发生的电极反应为
2SOCl2+4e-=4Cl-+S+SO2
2SOCl2+4e-=4Cl-+S+SO2
;(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,发生反应的化学方程式为
SOCl2+H2O=SO2↑+2HCl↑
SOCl2+H2O=SO2↑+2HCl↑
.(2009?海南)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.
请回答下列问题:
(1)电池的负极材料为
(2)电池正极发生的电极反应为
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成. 如果把少量水滴到SOCl2中,实验现象是
(4)组装该电池必须在无水、无氧的条件下进行,原因是
查看习题详情和答案>>
请回答下列问题:
(1)电池的负极材料为
锂
锂
,发生的电极反应为Li-e-=Li+
Li-e-=Li+
;(2)电池正极发生的电极反应为
2SOCl2+4e-=4Cl-+S+SO2
2SOCl2+4e-=4Cl-+S+SO2
;(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成. 如果把少量水滴到SOCl2中,实验现象是
出现白雾,有刺激性气体生成
出现白雾,有刺激性气体生成
,反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑
SOCl2+H2O=SO2↑+2HCl↑
;(4)组装该电池必须在无水、无氧的条件下进行,原因是
锂是活泼金属,易与H2O、O2反应,SOCl2也可与水反应
锂是活泼金属,易与H2O、O2反应,SOCl2也可与水反应
. (I)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.
(I)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.请回答下列问题:
(1)电池的负极材料为
(2)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成. 如果把少量水滴到SOCl2中,实验现象是
(3)组装该电池必须在无水、无氧的条件下进行,原因是
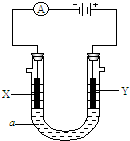
(Ⅱ)电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1).如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:①X的电极反应式是
(2).在图的基础上,用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH.则电解过程中转移的电子数为
(1)某研究性学习小组设计了如图1所示装置探究钢铁的腐蚀与防护.
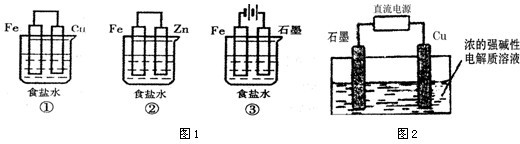
在相同条件下,三组装置中铁电极腐蚀最快的是
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车.电池反应为FePO4+Li
LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电.该电池放电时Li+向
(3)Cu2O是一种半导体材料,可通过如图2的电解装置制取,电解总反应为:2Cu+H2O
Cu2O+H2.阴极的电极反应式是
查看习题详情和答案>>

在相同条件下,三组装置中铁电极腐蚀最快的是
①
①
(填装置序号),该装置中正极电极反应式为O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;为防止金属Fe被腐蚀,可以采用上述②③
②③
(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为2Cl-+2H2O
2OH-+Cl2↑+H2↑
| ||
2Cl-+2H2O
2OH-+Cl2↑+H2↑
.
| ||
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车.电池反应为FePO4+Li
| 放电 |
| 充电 |
正
正
极移动(填“正”或“负”),负极反应为Li-e-=Li+,则正极反应式为FePO4+Li++e-=LiFePO4
FePO4+Li++e-=LiFePO4
.(3)Cu2O是一种半导体材料,可通过如图2的电解装置制取,电解总反应为:2Cu+H2O
| ||
2H++2e-=H2
2H++2e-=H2
.若用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时,Cu2O的理论产量为7.2
7.2
g.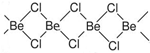 锂和铍单质及化合物的性质具有特殊性.
锂和铍单质及化合物的性质具有特殊性.