摘要: 答案:(1)反应①的方程式:4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O (2)反应②的离子方程式:6I-+ClO3- +6H+ = 3I2+Cl-+3H2O (3)2H2O22H2O+O2↑或2KMnO4K2MnO4+MnO2+O2↑ (4)5.6×10-4 mol·L-1 [解析]首先得破框图.G为紫黑色固体单质.一般可预测为碘单质.可推得C物质为氯气.则A为盐酸.B为二氧化锰,E在二氧化锰的催化下制取H.则E为氯酸钾.H为氧气,F为氯化钾,于是D一定为碘化钾.所以推出A盐酸.B二氧化锰.C氯气.D碘化钾.E氯酸钾.F氯化钾.G碘.H氧气. (4)D溶液与Pb(NO3)2 反应生成沉淀为PbI2.PbI2Pb2++2I- Ksp = c(Pb2+)·c(I-)2 = c(Pb2+)÷2×(10-2÷2)2 = 7.0×10-9 所以c(Pb2+) = 5.6×10-4 mol·L-1. 9.答案:(1)蒸馏法.电渗析法.离子交换法及其他合理答案中的任意两种 (2)Cl2 NaOH NaClO (3)富集溴元素 (4)Br2+SO2+2H2O = 4H++SO42 -+2Br- 强酸对设备的严重腐蚀 (5)①冷凝管 ②Br2腐蚀橡胶 ③控制温度计b的温度.并收集59 ℃时的馏分 ④深红棕色 分液(或蒸馏) [解析]本题考查海水中提取溴的实验. (2)从反应2NaCl+2H2O2NaOH+H2↑+Cl2↑可判断出产物.但其中Cl2有可能与NaOH反应生成NaClO. (3)步骤I中Br2的浓度很小.若把其中的Br2蒸馏出来.耗能太大.所以要先把Br2富集. (5)③蒸馏的目的.就是通过沸点不同而提纯Br2.所以要把温度控制在Br2的沸点.尽可能只使Br2挥发. () 来源: 版权所有:() 版权所有:() 版权所有:()
网址:http://m.1010jiajiao.com/timu3_id_59791[举报]
物质的浓度差异可导致物质的性质发生改变,不同浓度的物质在发生化学反应时其反应速率也会发生改变.
(1)浓硫酸具有:①强氧化性;②吸水性;③脱水性.以下过程主要表现浓硫酸的那些性质?请将答案填在横线上.
a.纸张、木条等遇浓硫酸会慢慢变黑;
b.浓硫酸可用于干燥H2、O2、SO2等气体;
c.常温下,铁或铝在浓硫酸中钝化;
(2)某学生进行了“浓度影响化学反应速率”的探究实验,原始数据记录如下:
①上述反应的方程式为:Zn+H2SO4=ZnSO4+H2↑,该反应既属于氧化还原反应,又属于
②比较两组数据可知:硫酸的浓度越大,化学反应速率
查看习题详情和答案>>
(1)浓硫酸具有:①强氧化性;②吸水性;③脱水性.以下过程主要表现浓硫酸的那些性质?请将答案填在横线上.
a.纸张、木条等遇浓硫酸会慢慢变黑;
③
③
(填写序号,下同).b.浓硫酸可用于干燥H2、O2、SO2等气体;
②
②
.c.常温下,铁或铝在浓硫酸中钝化;
①
①
.(2)某学生进行了“浓度影响化学反应速率”的探究实验,原始数据记录如下:
| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 10g(锌粉) | 0.1mol/L | 125s |
| ② | 10g(锌粉) | 0.2mol/L | 62s |
置换反应
置换反应
反应(填四大基本反应类型名称).②比较两组数据可知:硫酸的浓度越大,化学反应速率
越快
越快
(填“越快”、“越慢”或“不变”).物质的浓度差异可导致物质的性质发生改变,不同浓度的物质在发生化学反应时其反应速率也会发生改变.
(1)浓硫酸具有:①强氧化性;②吸水性;③脱水性.以下过程主要表现浓硫酸的那些性质?请将答案填在横线上.
a.纸张、木条等遇浓硫酸会慢慢变黑;______(填写序号,下同).
b.浓硫酸可用于干燥H2、O2、SO2等气体;______.
c.常温下,铁或铝在浓硫酸中钝化;______.
(2)某学生进行了“浓度影响化学反应速率”的探究实验,原始数据记录如下:
| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 10g(锌粉) | 0.1mol/L | 125s |
| ② | 10g(锌粉) | 0.2mol/L | 62s |
②比较两组数据可知:硫酸的浓度越大,化学反应速率______(填“越快”、“越慢”或“不变”). 查看习题详情和答案>>
(1)B中的含氧官能团为醛基、羧基,故答案为:醛基、羧基;
(2)A→C的变化为-OH在浓硫酸作用下发生消去反应生成C=C,C和D分子式相同,但结构不同,属于同分异构体,
故答案为:消去反应;C和D.
(3)A中含有-OH,在催化剂条件下可被氧化生成-CHO,反应的方程式为
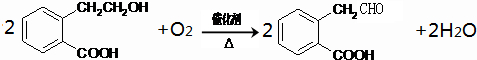
,
故答案为:

;
(4)C中含有C=C,可发生加聚反应,反应的方程式为

,
故答案为:

.
查看习题详情和答案>>
(2)A→C的变化为-OH在浓硫酸作用下发生消去反应生成C=C,C和D分子式相同,但结构不同,属于同分异构体,
故答案为:消去反应;C和D.
(3)A中含有-OH,在催化剂条件下可被氧化生成-CHO,反应的方程式为

,
故答案为:

;
(4)C中含有C=C,可发生加聚反应,反应的方程式为

,
故答案为:

.
物质的浓度差异可导致物质的性质发生改变,不同浓度的物质在发生化学反应时其反应速率也会发生改变.
(1)浓硫酸具有:①强氧化性;②吸水性;③脱水性.以下过程主要表现浓硫酸的那些性质?请将答案填在横线上.
a.纸张、木条等遇浓硫酸会慢慢变黑; (填写序号,下同).
b.浓硫酸可用于干燥H2、O2、SO2等气体; .
c.常温下,铁或铝在浓硫酸中钝化; .
(2)某学生进行了“浓度影响化学反应速率”的探究实验,原始数据记录如下:
①上述反应的方程式为:Zn+H2SO4=ZnSO4+H2↑,该反应既属于氧化还原反应,又属于 反应(填四大基本反应类型名称).
②比较两组数据可知:硫酸的浓度越大,化学反应速率 (填“越快”、“越慢”或“不变”). 查看习题详情和答案>>
(1)浓硫酸具有:①强氧化性;②吸水性;③脱水性.以下过程主要表现浓硫酸的那些性质?请将答案填在横线上.
a.纸张、木条等遇浓硫酸会慢慢变黑; (填写序号,下同).
b.浓硫酸可用于干燥H2、O2、SO2等气体; .
c.常温下,铁或铝在浓硫酸中钝化; .
(2)某学生进行了“浓度影响化学反应速率”的探究实验,原始数据记录如下:
| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 10g(锌粉) | 0.1mol/L | 125s |
| ② | 10g(锌粉) | 0.2mol/L | 62s |
②比较两组数据可知:硫酸的浓度越大,化学反应速率 (填“越快”、“越慢”或“不变”). 查看习题详情和答案>>
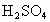 加到固体KAt上,估计发生反应的方程式为_________,产生的现象是______________.
加到固体KAt上,估计发生反应的方程式为_________,产生的现象是______________.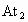 是否溶于
是否溶于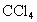 ?
?