网址:http://m.1010jiajiao.com/timu3_id_59703[举报]
相同温度下,在四个密闭容器中发生可逆反应:H2(g)+I2(g) 2HI(g),实验测得起始、平衡时的有关数据如下表所示:
2HI(g),实验测得起始、平衡时的有关数据如下表所示:
|
容器编号[来源:学_科_网] |
起始时各物质的物质的量(mol)[来源:ZXXK][来源:学_科_网Z_X_X_K][来源:学|科|网] |
达平衡时体系的变化[来源:学+科+网Z+X+X+K] |
||
|
I2 |
H2 |
HI |
||
|
① |
1 |
3 |
0 |
放出热量:Q1=23.15kJ |
|
② |
0.8 |
2.8 |
0.4 |
平衡时碘化氢的体积分数为20% |
|
③ |
0 |
4 |
4 |
|
|
④ |
2 |
3 |
0 |
|
(1)下列叙述正确的是
A.四个容器中反应的平衡常数相等
B.反应的热化学方程式为:H2(g)+I2(g) 2HI(g) △ H =23.15kJ/mol
2HI(g) △ H =23.15kJ/mol
C.平衡时,容器④中H2的转化率高于① D、容器②中达平衡时放出的热量Q2<23.15kJ
E、达到平衡后若将容器①的体积变为0.25 L,H2的转化率提高
(2)该温度下,在容积为1L密闭容器③中发生反应建立平衡,若达到平衡所需的时间为2min,则平均反应速率v(HI)= ,该温度下,反应H2(g)+I2(g) 2HI(g)的平衡常数 K=
。
2HI(g)的平衡常数 K=
。
(3)平衡常数K只受温度的影响,与浓度、压强等因素无关,故可利用平衡常数来判断平衡是否移动及移动的方向。例如,若③为一个装有可移动活塞的容器,上述平衡达成后用外力将活塞向内推至容积为0.5L并恢复原温度,则由于
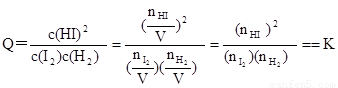 ,
,
可判断平衡将 (填“正向”、“逆向”或“不”)移动。
(4)如果保持温度和压强不变,向③的平衡体系中加入1.6molI2,平衡将 (填“正向”、“逆向”或“不”)移动,理由是 。
查看习题详情和答案>>

| A、四个“封管实验”中所发生的化学反应都是可逆反应 | B、加热时,②、③溶液均变红,冷却后又都变为无色 | C、加热时,①上部汇集了固体NH4C1,说明NH4Cl的热稳定性比较好 | D、④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
在NH4+离子中存在4个N-H共价键,则下列说法正确的是( )
A.四个共价键的键长完全相同
B.四个共价键的键长完全不同
C.原来的三个N-H的键长完全相同,但与由配位键形成的N-H键不同。
D.四个N-H键键长相同,但键能不同
查看习题详情和答案>>
在NH4+离子中存在4个N-H共价键,则下列说法正确的是( )
A.四个共价键的键长完全相同
B.四个共价键的键长完全不同
C.原来的三个N-H的键长完全相同,但与由配位键形成的N-H键不同。
D.四个N-H键键长相同,但键能不同
查看习题详情和答案>>
针对以下A—D四个涉及H2O2的反应(未配平):
A.Na2O2+HCl![]() H2O2+NaCl
H2O2+NaCl
B.Ag2O+H2O2![]() Ag+O2+H2O
Ag+O2+H2O
C.H2O2![]() H2O+O2
H2O+O2
D.H2O2+Cr2(SO4)3+KOH![]() K2SO4+K2CrO4+H2O
K2SO4+K2CrO4+H2O
请完成下列问题:
(1)H2O2仅表现氧化性的反应是_______________(填编号,下同),并配平此化学反应方程式:______________________。
(2)H2O2既表现氧化性又表现还原性的反应是___________。
(3)H2O2仅表现弱酸性的反应是___________,其理由为__________________________。
查看习题详情和答案>>