网址:http://m.1010jiajiao.com/timu3_id_59625[举报]
氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是 ( )
A.S2Cl2的结构式为Cl-S-S-Cl
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
【解析】根据氯化二硫的结构示意图可判断,硫和硫之间形成的是非极性键,硫和氯之间形成的是极性键,但氯化二硫不是直线型结构,因此属于极性分子,形成的晶体是分子晶体,所以A正确,B不正确。S2Br2与S2Cl2结构相似,所以S2Br2也是分子晶体,但S2Br2的相对分子质量比S2Cl2的大,因此C正确。能使品红褪色的气体是二氧化硫,而在S2Cl2中硫的化合价是+1价,所以S2Cl2和水的反应是氧化还原反应。由于二氧化硫是氧化产物,所以还应该有还原产物单质硫生成,孤选项D也正确。答案是B。
查看习题详情和答案>>
氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是 ( )

A.S2Cl2的结构式为Cl-S-S-Cl
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl
【解析】根据氯化二硫的结构示意图可判断,硫和硫之间形成的是非极性键,硫和氯之间形成的是极性键,但氯化二硫不是直线型结构,因此属于极性分子,形成的晶体是分子晶体,所以A正确,B不正确。S2Br2与S2Cl2结构相似,所以S2Br2也是分子晶体,但S2Br2的相对分子质量比S2Cl2的大,因此C正确。能使品红褪色的气体是二氧化硫,而在S2Cl2中硫的化合价是+1价,所以S2Cl2和水的反应是氧化还原反应。由于二氧化硫是氧化产物,所以还应该有还原产物单质硫生成,孤选项D也正确。答案是B。
查看习题详情和答案>>
进行这项实验的科学家,便是在铁质增加后的海域中(近南极的海域),长期追踪植物性浮游生物,以及其它海中生物的繁殖情况,试图找出答案.然而也有一些生态学家提出如下的警告:即使这项实验证明在海中施以铁肥可以减低大气中的CO2浓度,但干扰或破坏海洋中的食物链,也可能对海洋生态造成急遽且负而的影响.上述这些在科学上的争论,都需要更多的科学研究,才能进行较深入的探讨与了解。
试根据本文叙述,回答下列问题。
B.33
C.22
D.11
E.5.5

B.XCl2
C.Cl2
D.Y
E.YCl2
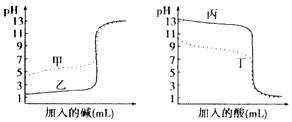
B.乙丙丁
C.甲乙丁
D.甲丙丁
E.甲乙丙
B.氖
C.氩
D.氪
E.氡

B.NaHCO3
C.Na2CO3
D.(NH4)2CO3
E.NH4Cl
某兴趣小组设计并进行了以下实验来制取氯水,并利新制用氯水完成实验。
(1)实验室拟用下列装置制备氯水,请按照气体从左向右流动的方向将仪器进行连接:
H→ _____________(填接口处的符号);广口瓶Ⅱ中的试剂为 。
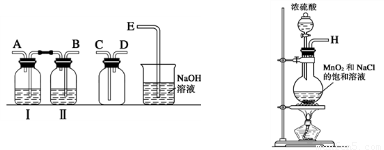
(2)写出该实验中制取Cl2的化学方程式为:___________________________________
(3)某兴趣小组设计实验除去氯化钾中含有Fe3+、SO42-、Br-等杂质离子,步骤如下:
A.溶解,在所得溶液中加入试剂至Fe3+、SO42-沉淀完全,煮沸;
B.过滤,在滤液中加入盐酸调节pH;
C.加入_____(除Br-);蒸干灼烧。请回答问题:
(3)①步骤a中,依次加入的试剂是NH3.H2O、_________、_________。
②步骤c中加入的试剂是__________________。
(4)某研究性学习小组用KSCN检验FeSO4溶液中的Fe2+时,加入过量浓HNO3,溶液的颜色变红。但是将红色溶液放置一会则发现溶液由红色突然变为蓝色,并产生红棕色气体。对这一奇特现象同学们进行了以下探究。
[查阅资料]:
(SCN)2称为拟卤素,性质与卤素单质相似,(SCN)2、Cl2、Br2、I2四种物质的氧化性强弱为:Cl2>Br2>(SCN)2>I2。
[提出假设]:
①甲同学假设是FeSO4与HNO3作用;乙同学假设是______与HNO3作用。
[实验验证]:
②大家经过理性分析,认为甲同学的假设不成立。理由是________________________。
③根据乙同学的假设,设计了如下实验方案进行验证:向浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深色,突然剧烈反应产生大量气泡,放出红棕色气体。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(是空气中的主要成分之一);向反应后的溶液中加入BaCl2溶液产生白色沉淀。
则反应中产生的气体是:_______________________________
[实验结论]:乙同学假设正确。
[实验反思]:
④由实验可知:用SCN-间接检验Fe2+时,加入的氧化剂除用HNO3外还可以选择氯水等,通过该实验探究可知加入氧化剂的量必须要_______(填“少量”、“过量”)。
查看习题详情和答案>>
某兴趣小组设计并进行了以下实验来制取氯水,并利新制用氯水完成实验。
(1)实验室拟用下列装置制备氯水,请按照气体从左向右流动的方向将仪器进行连接:
H→ _____________(填接口处的符号);广口瓶Ⅱ中的试剂为 。
(2)写出该实验中制取Cl2的化学方程式为:___________________________________
(3)某兴趣小组设计实验除去氯化钾中含有Fe3+、SO42-、Br-等杂质离子,步骤如下:
A.溶解,在所得溶液中加入试剂至Fe3+、SO42-沉淀完全,煮沸;
B.过滤,在滤液中加入盐酸调节pH;
C.加入_____(除Br-);蒸干灼烧。请回答问题:
(3)①步骤a中,依次加入的试剂是NH3.H2O、_________、_________。
②步骤c中加入的试剂是__________________。
(4)某研究性学习小组用KSCN检验FeSO4溶液中的Fe2+时,加入过量浓HNO3,溶液的颜色变红。但是将红色溶液放置一会则发现溶液由红色突然变为蓝色,并产生红棕色气体。对这一奇特现象同学们进行了以下探究。
[查阅资料]:
(SCN)2称为拟卤素,性质与卤素单质相似,(SCN)2、Cl2、Br2、I2四种物质的氧化性强弱为:Cl2>Br2>(SCN)2>I2。
[提出假设]:
①甲同学假设是FeSO4与HNO3作用;乙同学假设是______与HNO3作用。
[实验验证]:
②大家经过理性分析,认为甲同学的假设不成立。理由是________________________。
③根据乙同学的假设,设计了如下实验方案进行验证:向浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深色,突然剧烈反应产生大量气泡,放出红棕色气体。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(是空气中的主要成分之一);向反应后的溶液中加入BaCl2溶液产生白色沉淀。
则反应中产生的气体是:_______________________________
[实验结论]:乙同学假设正确。
[实验反思]:
④由实验可知:用SCN-间接检验Fe2+时,加入的氧化剂除用HNO3外还可以选择氯水等,通过该实验探究可知加入氧化剂的量必须要_______(填“少量”、“过量”)。