网址:http://m.1010jiajiao.com/timu3_id_59618[举报]
氯化亚铜(CuCl)是重要的化工原料。工业上常通过下列反应制备CuCl:
2CuSO4+Na2SO3+2NaCl+Na2CO3→2CuCl↓+3Na2SO4+CO2↑
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为 。
(2)准确称取所配制的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60mLCe(SO4)2溶液。有关反应的离子方程式为:
Fe3++CuCl→Fe2++Cu2++Cl- Ce4++Fe2+→Fe3++Ce3+
已知国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。试通过计算说明上述样品中CuCl的质量分数是否符合国家标准。
查看习题详情和答案>>
为探究铜与浓硫酸的反应,甲、乙两同学分别设计了图1、图2所示装置,将足量铜和10 mL 18 mol·L-1浓硫酸共热,直到无气体生成为止(假定反应前后试管中溶液的体积不变)。


 图1
图2
图1
图2
(1)比较两实验装置,图2装置的优点是:① ;② 。
(2)①甲根据所学的化学知识认为还有一定量的硫酸剩余。甲认为硫酸剩余的理论依据是 。
②下列药品中能够用来证明反应结束后的烧瓶中确有硫酸剩余的是_______。(选填编号)
A.过量铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)乙在拆除图2装置前,不打开胶塞,为使装置中的残留气体完全被吸收,应当采取的操作是 。
(4)为定量测定当剩余硫酸浓度不大于何值时,铜与硫酸就不能反应,甲、乙两位同学进行了如下设计:
①甲方案:将产生的气体缓缓通过预先称量过的盛有 的干燥管,反应结束后再次称量,干燥管质量增加m g。其余酸浓度为 mol·L-1。
②乙方案:分离出反应后的溶液并加蒸馏水稀释至1 000 mL,取20.00 mL于锥形瓶中,滴入2~3滴 ,(选填“酚酞”、“甲基橙”)用0.1000mol·L-1标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),用去NaOH溶液V mL。其余酸浓度为 mol·L-1。
③甲、乙两方案比较,你认为误差较大的是 ,理由是 。
查看习题详情和答案>>
14分) DIS(Digital Information System)系统即数字化信息系统,它由传感器、数据采集器和计算机组成。DIS系统为化学教学提供了全新的技术手段和教学平台。某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。

实验步骤如下:
(1)用______________(填仪器名称)量取10.00mL食用白醋,在_________(填仪器名称)中用水稀释后转移到100mL___________(填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中。
(2)量取20.00mL上述溶液倒入烧杯中,连接好DIS系统(如右图),向烧杯中滴加浓度为0.1000mol·L-1的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见右下图)。

①用滴定管盛氨水前,滴定管要用____________润洗2~3遍,润洗的目的是____________。
②溶液导电能力随氨水体积变化的原因是___________________ _____________________。
③食用白醋中醋酸的物质的量浓度是_____________。
查看习题详情和答案>>
14分) DIS(Digital Information System)系统即数字化信息系统,它由传感器、数据采集器和计算机组成。DIS系统为化学教学提供了全新的技术手段和教学平台。某学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。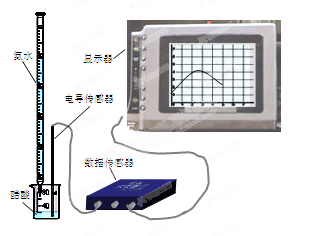
实验步骤如下:
(1)用______________(填仪器名称)量取10.00mL食用白醋,在_________(填仪器名称)中用水稀释后转移到100mL___________(填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中。
(2)量取20.00mL上述溶液倒入烧杯中,连接好DIS系统(如右图),向烧杯中滴加浓度为0.1000mol·L-1的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见右下图)。
①用滴定管盛氨水前,滴定管要用____________润洗2~3遍,润洗的目的是____________。
②溶液导电能力随氨水体积变化的原因是___________________ _____________________。
③食用白醋中醋酸的物质的量浓度是_____________。