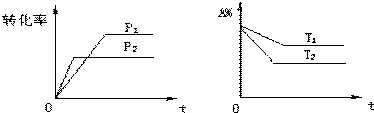
摘要:31.答案 (1)1s2s22p63s23p2, O>C>Si. (2)sp3, 共价键. (3)Mg, Mg2+半径比Ca2+小.MgO晶格能大. (4)C的原子半径较小.C.O原子能充分接近.p-p轨道肩并肩重叠程度较大.形成较稳定的p 键. 而Si的原子半径较大.Si.O原子间距离较大.p-p轨道肩并肩重叠程度较小.不能形成上述稳定的p键. [解析](1)C.Si和O的电负性大小顺序为:O>C>Si. (2)晶体硅中一个硅原子周围与4个硅原子相连.呈正四面体结构.所以杂化方式是sp3. (3)晶格能与所组成离子所带电荷成正比.与离子半径成反比.MgO与CaO的离子电荷数相同.Mg2+半径比Ca2+小.MgO晶格能大.所以熔点高.
网址:http://m.1010jiajiao.com/timu3_id_59574[举报]
(1)补充完成下表:(请把序号①一⑦的答案对应填入答题卡上)
(2)甲元素最高价氧化物对应的水化物呈
(3)甲与乙两元素的单质反应生成物的电子式为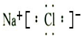
 .
.
(4)甲单质与丙的氢化物反应的化学方程式为
查看习题详情和答案>>
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① Na Na |
② Cl Cl |
0 |
| 原子结构示意图 | 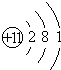 |
③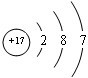  |
④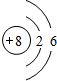 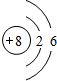 |
| 周期 | 三 | 三 | ⑤ 二 二 |
| 族 | ⑥ ⅠA ⅠA |
ⅦA | ⑦ ⅥA ⅥA |
碱
碱
性(填“酸、碱”),乙元素对应的水化物的化学式为HClO4
HClO4
.(3)甲与乙两元素的单质反应生成物的电子式为
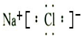
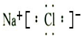
(4)甲单质与丙的氢化物反应的化学方程式为
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
.为探究验证分在空气中和人体呼出气体中含量的不同设计如下实验,答案写在相应的空格内(②③为人呼出气)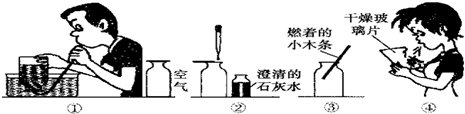
(1)②中现象:
(2)③中燃着小木条和在空气中燃烧现象有什么不同
(3)④实验目的是什么?
结论:与吸入空气相比,呼出气体中O2的量
查看习题详情和答案>>

(1)②中现象:
呼出的气体使石灰水出现的浑浊多
呼出的气体使石灰水出现的浑浊多
(2)③中燃着小木条和在空气中燃烧现象有什么不同
燃着小木条息熄灭;燃着的木条在空气中能够燃烧
燃着小木条息熄灭;燃着的木条在空气中能够燃烧
(3)④实验目的是什么?
证明呼出气体中水的含量比空气大
证明呼出气体中水的含量比空气大
结论:与吸入空气相比,呼出气体中O2的量
低
低
,CO2和H2O的量多
多
.