摘要:答案: (1)1s22s22p6 小 b (4)Cu 6 [解析]基态N3-的电子10个.已达稳定状态.故为1s22s22p6.计算可知.N≡N中的π键的键能为942 kJ·mol-1减去N-N单键的键能247 kJ·mol-1 .因此π键比σ键稳定.离子液体由阴.阳离子组成.其挥发性较小.且无污染.X+中所有电子正好充满KLM三个电子层.应含有28个电子.则X原子未29个电子.X的元素符号是Cu.X+ 和N3-组成比例为3:1.根据晶体结构图所示黑点为X+.白点为N3-.与同一个N3-相连的X+有6个.
网址:http://m.1010jiajiao.com/timu3_id_59557[举报]
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:(1)请从下表中实验现象(Ⅱ)(填A、B、C…)中选出与方案(I)(填1、2、3…)对应的实验现象,填入答案(Ⅲ)中.
(2)通过以上实验分析了同周期元素的符号
查看习题详情和答案>>
| 实验方案(I) | 实验现象(Ⅱ) | 答案(III) | |
| 实验方案I | 实验现象II | ||
| 1.用砂纸擦后的镁带与沸 水反应,再向反应液中滴 加酚酞 |
A浮与水面,剧烈反应,放出气体, 熔成-个小球,在水面上无定向移 动,随之消失,溶液变红色. |
1 | |
| 2.向新制的H2S饱和溶 液中滴加新制的氯水 |
B.产生大量气体,可在空气中燃 烧,溶液变成浅红色 |
2 | |
| 3.钠与滴有酚酞的冷水反应 | C.反应不十分剧烈,产生的气体 可以在空气中燃烧 |
3 | |
| 4.镁带与2mol/L的盐酸 反应 |
D.剧烈反应,产生的气体可以在 空气中燃烧 |
4 | |
| 5铝条与2mol/L的盐酸 反应 |
E.生成白色絮状沉淀,继而沉淀 消失 |
5 | |
| 6.向AlCl2溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 | 6 | |
Na、Mg、Al、S、Cl
Na、Mg、Al、S、Cl
,从实验结果可以得出的结论是同一周期元素的金属性从左到右逐渐减弱,非金属性逐渐增强
同一周期元素的金属性从左到右逐渐减弱,非金属性逐渐增强
.为探究验证分在空气中和人体呼出气体中含量的不同设计如下实验,答案写在相应的空格内(②③为人呼出气)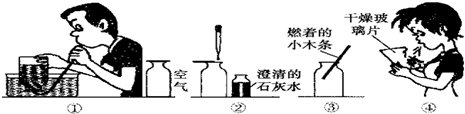
(1)②中现象:
(2)③中燃着小木条和在空气中燃烧现象有什么不同
(3)④实验目的是什么?
结论:与吸入空气相比,呼出气体中O2的量
查看习题详情和答案>>

(1)②中现象:
呼出的气体使石灰水出现的浑浊多
呼出的气体使石灰水出现的浑浊多
(2)③中燃着小木条和在空气中燃烧现象有什么不同
燃着小木条息熄灭;燃着的木条在空气中能够燃烧
燃着小木条息熄灭;燃着的木条在空气中能够燃烧
(3)④实验目的是什么?
证明呼出气体中水的含量比空气大
证明呼出气体中水的含量比空气大
结论:与吸入空气相比,呼出气体中O2的量
低
低
,CO2和H2O的量多
多
.为节省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液、直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),通过巧妙的构思,设计了比较铜、锌金属活动性相对强弱的系列实验.试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),向烧杯中小心加入稀硫酸,观察到的现象是
(2)乙同学接着甲的实验,向烧杯中滴加
乙同学作出锌、铜金属活动性相对强弱的结论所依据的原理是
(3)丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的试剂
(4)请你再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌、铜金属活动性的相对强弱(简要说明操作和现象)
查看习题详情和答案>>
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),向烧杯中小心加入稀硫酸,观察到的现象是
锌片上有气泡产生,铜片上无气泡
锌片上有气泡产生,铜片上无气泡
.甲同学的设计思路是锌能置换出酸中的氢,而铜不能
锌能置换出酸中的氢,而铜不能
.(2)乙同学接着甲的实验,向烧杯中滴加
硫酸铜
硫酸铜
溶液,进而观察到的现象是锌片上有红色的铜析出,锌片上产生气泡的速率明显加快
锌片上有红色的铜析出,锌片上产生气泡的速率明显加快
.乙同学作出锌、铜金属活动性相对强弱的结论所依据的原理是
活泼金属可以把不活泼金属从其盐溶液中置换出来(或Zn、Cu、稀硫酸组成原电池,Zn为负极)
活泼金属可以把不活泼金属从其盐溶液中置换出来(或Zn、Cu、稀硫酸组成原电池,Zn为负极)
.(3)丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的试剂
硫酸铜
硫酸铜
溶液(作为电解液).反应在调控下随即开始,实验中有关反应的化学方程式为2CuSO4+2H2O
2Cu+O2↑+2H2SO4
| ||
2CuSO4+2H2O
2Cu+O2↑+2H2SO4
.实验中的明显现象是
| ||
阴极上有红色铜析出,阳极附近有气体产生
阴极上有红色铜析出,阳极附近有气体产生
.(4)请你再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌、铜金属活动性的相对强弱(简要说明操作和现象)
分别取一小片铜片与锌片置于两支试管中,向试管中加入少量浅绿色的FeCl2溶液,片刻后,加锌片的试管中溶液的颜色褪去,溶液近乎无色(其他可行答案也可)
分别取一小片铜片与锌片置于两支试管中,向试管中加入少量浅绿色的FeCl2溶液,片刻后,加锌片的试管中溶液的颜色褪去,溶液近乎无色(其他可行答案也可)
.根据“三氟化硼→正三角形→非极性分子”的因果关系,则“三氯甲烷→( ①)→( ②)”的因果关系是 _______.
A、正四面体 B、非正四面体 C、非极性分子 D、极性分子 E、四边形
答案:①
查看习题详情和答案>>
A、正四面体 B、非正四面体 C、非极性分子 D、极性分子 E、四边形
答案:①
B
B
;②D
D
.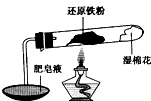 在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成Fe0,高于570℃时,生成Fe304.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成Fe0,高于570℃时,生成Fe304.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.(1)实验中使用肥皂液的作用是
检验反应中生成的H2
检验反应中生成的H2
.(2)甲同学为探究实验后试管内的固体X中含有哪些物质,进行了下列实验.
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
Fe
Fe
;不能确定是否存在Fe0的原因是铁与盐酸反应生成了氯化亚铁,或者 Fe3O4溶于盐酸生成的Fe3+与Fe反应生成了Fe2+
铁与盐酸反应生成了氯化亚铁,或者 Fe3O4溶于盐酸生成的Fe3+与Fe反应生成了Fe2+
.(3)乙同学设计下列实验方案以确定实验后试管内的固体中是否存在FeO.
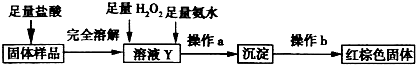
确定是否存在Fe0需要测定并记录的实验数据是
固体样品质量和红褐色固体的质量(其他合理答案也可)
固体样品质量和红褐色固体的质量(其他合理答案也可)
.