摘要:3.答案:(1)研究反应物I-与S2O2-8的浓度对反应速率的影响. (2)29.3s (3)A (4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比) [解析](2)分析所给数据.可以得出显色时间与c(I-).c (S2O)数值成反比.利用①.⑤两组数据.可知两组实验中c(S2O)相同.而c(I-)⑤是①的3倍.因此⑤所用显色时间是①的s. (3)在反应物起始浓度相同的条件下.温度越高.反应速率越快.则显色时间越短.故选A.
网址:http://m.1010jiajiao.com/timu3_id_59437[举报]
 已知反应:3I-(aq)+
已知反应:3I-(aq)+| S 2O | 2- 8 |
- 3 |
| 2SO | 2- 4 |
(1)写出反应的平衡常数表达式K=
c
| ||||
c3(I-)?c
|
c
| ||||
c3(I-)?c
|
(2)如图表示反应过程中有关物质的能量,则反应的△H
<
<
0(填“>”、“<”或“=”);(Ⅰ)、(Ⅱ)两线中,使用催化剂的是
(Ⅱ)
(Ⅱ)
线;(3)反应中发生反应的I-与被氧化的I-的物质的量比为
3:2
3:2
;(4)反应的速率可以用
| I | - 3 |
| 实验编号 | ① | ② | ③ | ④ | ⑤ | ||
| c(I-)/mol?L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 | ||
c(
|
0.040 | 0.040 | 0.080 | 0.080 | 0.040 | ||
| t/s | 88 | 44 | 22 | 11 | t1 |
研究反应物I-与S2O82-的浓度对反应速率的影响
研究反应物I-与S2O82-的浓度对反应速率的影响
,显色时间t1=22
22
s,分析表中数据,得出的结论是反应速率与反应物起始浓度乘积成正比
反应速率与反应物起始浓度乘积成正比
.“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如下表:
回答下列问题:
(1)该实验的目的是
(2)显色时间t2=
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为
A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是
查看习题详情和答案>>
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol?L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O82-)/mol?L-1 | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
(1)该实验的目的是
研究反应物I-与S2O82-的浓度对反应速率的影响
研究反应物I-与S2O82-的浓度对反应速率的影响
.(2)显色时间t2=
29.3s
29.3s
.(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为
A
A
(填字母).A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是
反应速率与反应物起始浓度乘积成正比或显色时间与反应物起始浓度乘积成反比
反应速率与反应物起始浓度乘积成正比或显色时间与反应物起始浓度乘积成反比
.Ⅰ用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
Ⅱ“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如下表:
回答下列问题:
(1)该实验的目的是
(2)显色时间t2=
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为
A<22.0s B 22.0~44.0s C>44.0s D 数据不足,无法判断.
查看习题详情和答案>>
ADE
ADE
.A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
Ⅱ“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如下表:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol?L- | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| C(S2O82-)/mol?L- | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
(1)该实验的目的是
研究反应物I-与S2O82-的浓度对反应速率的影响
研究反应物I-与S2O82-的浓度对反应速率的影响
.(2)显色时间t2=
29.3s
29.3s
.(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为
A
A
(填字母)A<22.0s B 22.0~44.0s C>44.0s D 数据不足,无法判断.
(2009?福建)某探究小组利用丙酮的溴代反应(CH3COCH3+Br2
| ||||||||||||||||||||||||||||||
查看习题详情和答案>>
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2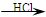 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
|
实验 序号 |
初始浓度c/mol·L-1 |
溴颜色消失 所需时间t/s |
||
|
CH3COCH3 |
HCl |
Br2 |
||
|
① |
0.80 |
0.20 |
0.0010 |
290 |
|
② |
1.60 |
0.20 |
0.0010 |
145 |
|
③ |
0.80 |
0.40 |
0.0010 |
145 |
|
④ |
0.80 |
0.20 |
0.0020 |
580 |
分析实验数据所得出的结论不正确的是
A.增大c(Br2),v(Br2)增大 B.实验②和③的v(Br2)相等
C.增大c(HCl), v(Br2)增大 D.增大c(CH3COCH3), v(Br2)增大
查看习题详情和答案>>