网址:http://m.1010jiajiao.com/timu3_id_59413[举报]
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3;2SO2(g)+O2(g)![]() 2SO3(g)某温度下,SO2的平衡化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题。
2SO3(g)某温度下,SO2的平衡化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题。
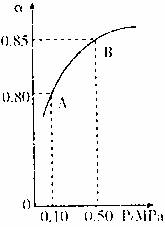
①平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”、“=”)。
②已知上述反应的是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列选项中有利于提高SO2平衡转化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.移出氧气
③SO2尾气用Na2SO3溶液吸收可得到重要化工原料,反应的化学方程式为
;上述反应产物的水溶液呈酸性,原因 。
④工业制硫酸中SO2的一种制法是煅烧FeS2制取,煅烧FeS2的产物之一Fe3O4溶于H2SO4后,加入Fe粉可制取FeSO4,酸溶过程需保持溶液足够酸性,其原因是
。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
若用标准状况下4.48L CH4还原NO2至N2的整个过程中转移的电子总数为
(阿伏加德罗常的值用NA表示),写出上述反应的热化学方程式:
。
查看习题详情和答案>> 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.(1)一定条件下,2SO3(g)?2SO2(g)+O2(g),向1.6LA(A容器可以自由滑动)和2LB密闭容器中各通入2mol SO3(g),在相同温度和有催化剂的条件下两容器各自达到平衡,测得A容器为1.8L,则A容器中SO3的转化率为
(2)打开K一段时间再达平衡时,A容器的体积为
(3)用CH4催化还原NOx为N2可以消除氮氧化物的污染.试写出总反应方程式:
(4)CO在催化条件下也可以消除NO的污染.要计算该反应消耗1molCO的焓变△H.请依据盖斯定律设计:利用两个已知化学反应的焓变(焓变分别设为△H1、△H2)计算△H的过程
 二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
| 催化剂 | △ |
某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示.根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数等于
②平衡状态由A变到B时.平衡常数K(A)
(2)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为
(1)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应.下列有关说法正确的是
A.停止使用氟里昂是为保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾-淀粉试纸变蓝
(2)一定条件下,2SO2(g)+O2(g)?2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=
(3)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气,臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如图:

用臭氧消毒自来水,适宜的条件是

(4)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
若2mol ZnFe2Ox与SO2可生成0.75mol S,x=
A.任何从试剂瓶中取出的药品,若有剩余均不能再放回原试剂瓶
B.用稀盐酸洗涤盛放过石灰水的试剂瓶
C.配制H2SO4溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
D.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
E.Na2CO3溶液不能保存在带有磨口玻璃塞的试剂瓶中
F.将用水润湿的PH试纸浸入稀盐酸中,测定溶液的PH
(2)据报道,目前一些地区酸雨、灰霾和光化学烟雾等区域性大气污染突出,严重威胁群众健康,影响环境安全.二氧化硫和氮的氧化物是大气的主要污染物,关注臭氧层、防止和治理环境污染是当前环保工作的重要研究内容之一.
①汽车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等到物质,这种尾气越来越成为城市空气污染的主要来源,汽车尾气中的CO来自
| ||
| ||
②空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应.下列有关说法正确的是
A.停止使用氟里昂是为了保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾一淀粉试纸变蓝
③在一定条件下用氨可将氮氧化物转化为无毒气体.同温同压下,7L NH3恰好将6L NO和NO2的混合气体完全转化为N2,则原混合气体中NO和NO2的体积比是