摘要:11..[江苏省淮安市2008-2009学年度高三第四次调研] 三氟化氮是一种无色.无味.无毒且不可燃的气体.在半导体加工.太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子.键角102 °.沸点-129 ℃,可在铜的催化作用下由F2和过量NH3反应得到. (1)写出制备 NF3的化学反应方程式: . (2)NF3的沸点比NH3的沸点低得多的主要原因是 . (3)与铜属于同一周期.且未成对价电子数最多的元素基态原子核外电子排布式为 . (4)理论上HF.NaAlO2和NaCl按6∶1∶2的物质的量之比恰好反应生成HCl.H2O和一种微溶于水的重要原料.该物质含有三种元素.则其中心离子是 .配位数为 . (5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1 ).回答下面各题: 元素代号 I1 I2 I3 I4 Q 2080 4000 6100 9400 R 500 4600 6900 9500 S 740 1500 7700 10500 T 580 1800 2700 11600 U 420 3100 4400 5900 ①在周期表中.最可能处于同一族的是 和 . ②T元素最可能是 区元素.若T为第二周期元素.F是第三周期元素中原子半径最小的元素.则T.F形成化合物的空间构型为 .其中心原子的杂化方式为 . 答案.. (除注明外其余空格各1分) (1)4NH3+3F2=NF3+3NH4F (2)NH3能形成氢键.NF3只有范德华力 (3)1s22s22p63s23p63d54s1(或[Ar] 3d54s1) (4)Al 6 (5)① R U ② P 平面正三角形 sp2
网址:http://m.1010jiajiao.com/timu3_id_59259[举报]
| 无内容 |
| 无内容 |
| 无内容 |
[江苏省南通中学2008学年度第一学期期末复习高三化学 ].某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙、丙三套装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分。仪器中盛放的试剂为:a-无水乙醇(沸点:78 ℃);b-铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液。
(1)简述两套方案各自的优点:甲:_________________、_________________________,
乙:___________________
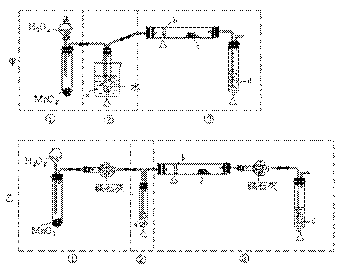 (2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为________________(例如甲①,乙②)
(2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为________________(例如甲①,乙②)
(3)若要保证此实验有较高的效率,还需补充的仪器有__________。理由______。
(4)实验中能验证乙醇氧化产物的实验现象是_______________。
(5)装置中,若撤去第①部分,其它操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式____________。
查看习题详情和答案>>