摘要:锌与100mL1mol/L盐酸反应的实验中.若设想向溶液中加入少量的①醋酸钠.②溴化铜.③醋酸铜.并测定生成H2的速率.预计三种方案的速率大小是 ( ) A.①>③>② B.③>②>① C.②>③>① D.①>②>③
网址:http://m.1010jiajiao.com/timu3_id_58926[举报]
下列依据相关实验得出的结论正确的是( )
| A、加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | B、纤维素的水解产物能够发生银镜反应,说明纤维素是一种还原性糖 | C、向某溶液中滴加硝酸酸化的Ba(NO3)2溶液产生白色沉淀,说明该溶液中含有SO42- | D、等物质的量浓度的H3PO4溶液的pH比H2SO4溶液大,说明硫比磷的非金属性强 |
在锌与盐酸反应的实验中,某学生得到的结果如下表所示:
(1)t1=
(2)根据表中数据得出关于温度影响反应速率的结论是
(3)t1
(4)t2
查看习题详情和答案>>
| 实验编号 | 锌的质量/g | 锌的形状 | 温度/℃ | 锌完全反应的时间/s |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 细小颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
50
50
s.(2)根据表中数据得出关于温度影响反应速率的结论是
反应温度升高10℃,化学反应速率加快到原来的2倍
反应温度升高10℃,化学反应速率加快到原来的2倍
.(3)t1
>
>
t4(填“>”、“<”、“=”),原因是构成原电池,加快反应速率
构成原电池,加快反应速率
.(4)t2
>
>
t3(填“>”、“<”、“=”),原因是F组接触面积大,反应速率快
F组接触面积大,反应速率快
.某校科技活动小组用镁粉、盐酸、醋酸设计以下实验,对两种酸分别与镁反应的速率和电离平衡理论进行研究,设计的实验装置如图所示(夹持固定装置已略去).
正确操作,记录得到下图2中部分实验数据.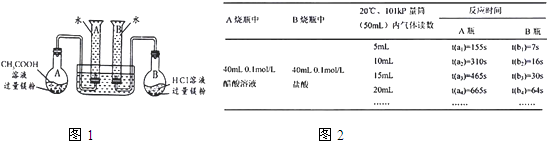
分析数据,观察实验装置图,回答下列问题:
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于
经小组研究后,稍作改进就可继续实验了;
(2)欲配置100mL实验所需浓度的盐酸,除烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是
(3)在实验数据中
①t(a1)远远大于t(b1)的原因为:
②由
(4)该实验得到什么结论?(回答出两点即可)
①
②
(5)通过实验判断,锌与稀盐酸制氢气时,若要减慢反应速率而不影响产生氢气的量,可以加入
查看习题详情和答案>>
正确操作,记录得到下图2中部分实验数据.

分析数据,观察实验装置图,回答下列问题:
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于
量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)
量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)
;经小组研究后,稍作改进就可继续实验了;
(2)欲配置100mL实验所需浓度的盐酸,除烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是
容量瓶(100mL)、玻璃棒
容量瓶(100mL)、玻璃棒
;(3)在实验数据中
①t(a1)远远大于t(b1)的原因为:
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
;②由
t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
[用含t(b1)、t(b2)、t(b3)代数式表示]说明盐酸是强酸,不存在电离平衡;由t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
[用含t(a1)、t(a2)、t(a3)代数式表示]说明醋酸中存在电离平衡.(4)该实验得到什么结论?(回答出两点即可)
①
相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)
相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)
;②
盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
.(5)通过实验判断,锌与稀盐酸制氢气时,若要减慢反应速率而不影响产生氢气的量,可以加入
CH3COONa固体、水或NaCl溶液
CH3COONa固体、水或NaCl溶液
(填写两种不同作用原理的物质).下列事实不能用电化学理论解释的是( )
| A、土壤内的输水钢管总是通过导线连接一镁块,并定时更换镁 | B、铝片可以露置在空气中存放 | C、轮船吃水线以下的船壳上装有一定数量的锌块 | D、纯锌与稀硫酸反应制取氢气时,滴入少量的硫酸铜溶液使反应速率加快 |
下列事实不能用电化学原理解释的是( )
| A、镀锌铁片比镀锡铁片更耐腐蚀 | B、远洋海轮的尾部装上一定数量的锌板 | C、常温条件下,在空气中铝不易被腐蚀 | D、用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 |