摘要:(三)分子间作用力与物质的性质 1.了解化学键和分子间作用力的区别. 2.了解氢键的存在对物质性质的影响.能列举含有氢键的物质. 3.了解分子晶体与原子晶体.离子晶体.金属晶体的结构微粒.微粒间作用力的区别. 有机化学基础
网址:http://m.1010jiajiao.com/timu3_id_58533[举报]
[化学--物质结构与性质]
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为
(2)NH3分子的空间构型是:
(3)NH3与PH3相比,热稳定性更强的是:
(4)一定压强,将NH3和PH3混合气体降温时,首先液化的物质是
(5)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有
查看习题详情和答案>>
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
.在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为正四面体
正四面体
.在四大晶体类型中,GaN属于原子
原子
晶体.(2)NH3分子的空间构型是:
三角锥型
三角锥型
,中心原子N的杂化轨道类型是:sp3
sp3
.(3)NH3与PH3相比,热稳定性更强的是:
NH3
NH3
,理由是:氮的原子半径比磷的原子半径小,N-H键长比P-H键长短,键能更大,分子更稳定
氮的原子半径比磷的原子半径小,N-H键长比P-H键长短,键能更大,分子更稳定
.(4)一定压强,将NH3和PH3混合气体降温时,首先液化的物质是
NH3
NH3
,理由是:因为氨分子之间存在氢键,使分子间作用力更大,沸点更高
因为氨分子之间存在氢键,使分子间作用力更大,沸点更高
.(5)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有
能够接受孤电子对的空轨道
能够接受孤电子对的空轨道
的原子或离子.确定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
A通常显______价,A的电负性______B的电负性;
A的第一电离能______B的第一电离能(填“>”、“<”或“=”).
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示,其中TiN中N呈-3价),已知3种离子晶体的晶格能数据如下表:
则该 4种离子晶体熔点从高到低的顺序是:______.其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有______个.
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是______.
(4)某配合物的分子结构如图2所示,其分子内不含有______(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢 键 F.非极性键
(5)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如右图所示.X的元素符号是______,与同一个N3-相连的X+有______个.
(6)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构.则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是______
A.SP,范德华力 B.sp2,范德华力 C.sp2,氢键 D.sp3,氢键
(7)CaC2中
与
互为等电子体,
的电子式可表示为______;1mol
中含有的π键数目为______.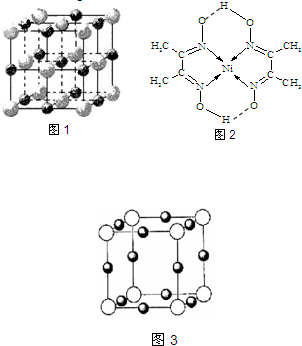
查看习题详情和答案>>
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
A的第一电离能______B的第一电离能(填“>”、“<”或“=”).
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图1所示,其中TiN中N呈-3价),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 | KCl | MgO | CaO |
| 晶格能/kJ?mol-1 | 715 | 3791 | 3401 |
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是______.
(4)某配合物的分子结构如图2所示,其分子内不含有______(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢 键 F.非极性键
(5)某离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如右图所示.X的元素符号是______,与同一个N3-相连的X+有______个.
(6)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构.则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是______
A.SP,范德华力 B.sp2,范德华力 C.sp2,氢键 D.sp3,氢键
(7)CaC2中
| C | 2-2 |
| O | 2+2 |
| O | 2+2 |
| O | 2+2 |

决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长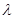 与光的频率v的关系为
与光的频率v的关系为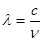 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
。(未说明原因不给分)
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是 。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5) [Cu(NH3)4]SO4中存在的化学键类型有 (填序号)。
A.共价键 B.氢键 C.离子键 D.配位键 E.分子间作用力
NH3分子的空间构型为 ,属于 分子(填“极性”或“非极性”)
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长
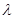 与光的频率v的关系为
与光的频率v的关系为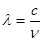 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
| 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5) [Cu(NH3)4]SO4中存在的化学键类型有 (填序号)。
A.共价键 B.氢键 C.离子键 D.配位键 E.分子间作用力
NH3分子的空间构型为 ,属于 分子(填“极性”或“非极性”)
[化学--选物质结构与性质]
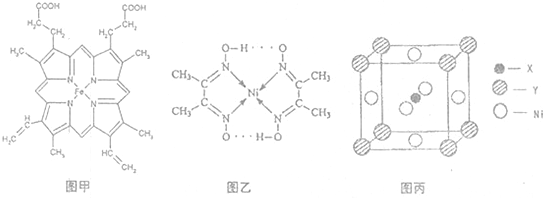
(1)如图甲,血红素含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是______,根据以上电负性请判断H2N-CHO中C和N的化合价分别为______和______.基态Fe原子的核外电子排布式为______.血红素中两种N原子的杂化方式分别为______、______.
(2)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.Cl2、IBr、ICl沸点由高到低的顺序为______.I+3(可看成II+2)属于多卤素阳离子,根据VSEPR模型推测I+3的空间构型为______.多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,则A的化学式为______.
①HClO4、②HIO4、③HIO6[可写成(HO)5IO]的酸性由强到弱的顺序为______(填序号).
(3)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.配合物Ni(CO)4常温为流态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于______晶体.如图乙配合物分子内的作用力除共价键外,还存在的两种作用力是______(填字母编号).
A.氢键 B.离子键 C.范德华力 D.配位键
(4)最近发现,只含X、Y和Ni三种元素的某种晶体具有超导性.X元素原子的2p能级的电子排布图为

,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为______.
查看习题详情和答案>>

(1)如图甲,血红素含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是______,根据以上电负性请判断H2N-CHO中C和N的化合价分别为______和______.基态Fe原子的核外电子排布式为______.血红素中两种N原子的杂化方式分别为______、______.
(2)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.Cl2、IBr、ICl沸点由高到低的顺序为______.I+3(可看成II+2)属于多卤素阳离子,根据VSEPR模型推测I+3的空间构型为______.多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,则A的化学式为______.
①HClO4、②HIO4、③HIO6[可写成(HO)5IO]的酸性由强到弱的顺序为______(填序号).
(3)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.配合物Ni(CO)4常温为流态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于______晶体.如图乙配合物分子内的作用力除共价键外,还存在的两种作用力是______(填字母编号).
A.氢键 B.离子键 C.范德华力 D.配位键
(4)最近发现,只含X、Y和Ni三种元素的某种晶体具有超导性.X元素原子的2p能级的电子排布图为

,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为______.
[化学--选物质结构与性质]
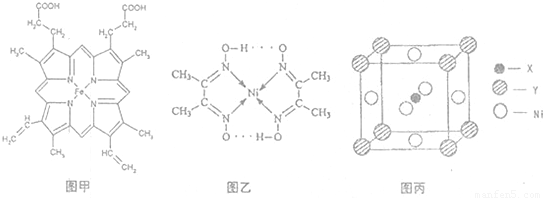
(1)如图甲,血红素含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是______,根据以上电负性请判断H2N-CHO中C和N的化合价分别为______和______.基态Fe原子的核外电子排布式为______.血红素中两种N原子的杂化方式分别为______、______.
(2)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.Cl2、IBr、ICl沸点由高到低的顺序为______.I+3(可看成II+2)属于多卤素阳离子,根据VSEPR模型推测I+3的空间构型为______.多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,则A的化学式为______.
①HClO4、②HIO4、③HIO6[可写成(HO)5IO]的酸性由强到弱的顺序为______(填序号).
(3)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.配合物Ni(CO)4常温为流态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于______晶体.如图乙配合物分子内的作用力除共价键外,还存在的两种作用力是______(填字母编号).
A.氢键 B.离子键 C.范德华力 D.配位键
(4)最近发现,只含X、Y和Ni三种元素的某种晶体具有超导性.X元素原子的2p能级的电子排布图为 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为______.
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为______.
查看习题详情和答案>>

(1)如图甲,血红素含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是______,根据以上电负性请判断H2N-CHO中C和N的化合价分别为______和______.基态Fe原子的核外电子排布式为______.血红素中两种N原子的杂化方式分别为______、______.
(2)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.Cl2、IBr、ICl沸点由高到低的顺序为______.I+3(可看成II+2)属于多卤素阳离子,根据VSEPR模型推测I+3的空间构型为______.多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,则A的化学式为______.
①HClO4、②HIO4、③HIO6[可写成(HO)5IO]的酸性由强到弱的顺序为______(填序号).
(3)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.配合物Ni(CO)4常温为流态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于______晶体.如图乙配合物分子内的作用力除共价键外,还存在的两种作用力是______(填字母编号).
A.氢键 B.离子键 C.范德华力 D.配位键
(4)最近发现,只含X、Y和Ni三种元素的某种晶体具有超导性.X元素原子的2p能级的电子排布图为
 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为______.
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为______.查看习题详情和答案>>