网址:http://m.1010jiajiao.com/timu3_id_58364[举报]
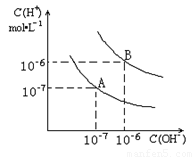
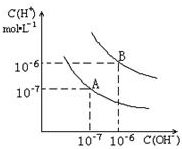 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:(1)25°C时,水的电离平衡曲线应为哪一条?请说明理由
(2)95°C时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与硫酸溶液的体积比为为多少?
(3)95°C时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是?
(4)曲线B对应的温度下,pH=2的某酸HA与pH=10的NaOH溶液等体积混合后,溶液的pH=5,请分析其原因
(1)我国目前使用的主要能源是化石燃料,化石燃料包括煤、
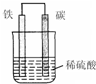
(2)右图是钢铁的吸氧腐蚀示意图,其中碳极(正极)的电极反应式为
(3)为保护地下钢管不受腐蚀,可使它与
A.铜板相连 B.碳棒相连
C.直流电源正极相连 D.锌板相连. 查看习题详情和答案>>
按要求完成下列各小题。
Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。
(1)已知某反应的平衡常数表达式为: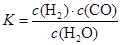
它所对应的化学方程式为: 。
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。
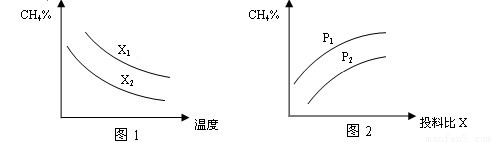
①图1中的两条曲线所示投料比的关系X2 ____ X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2 _______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:
②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6 ,则燃料电池的负极反应式为:
。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
查看习题详情和答案>>
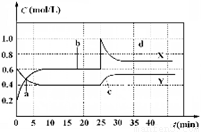
 N2O4(g);△H<0。现将一定量NO2和 N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是
N2O4(g);△H<0。现将一定量NO2和 N2O4的混合气体通入体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图。下列说法错误的是