摘要:请参考上述数据回答下列问题: (1)工业上常用电解熔融MgCl2的方法生产金属镁.电解Al2O3与冰晶石熔融混合物的方法生产铝.为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?答 . (2)设计可靠的实验证明MgCl2.AlCl3所属的晶体类型.其实验方法是 . 23.在极性分子中.正电荷重心同负电荷重心间的距离称偶极长.通常用d表示.极性分子的极性强弱同偶极长和正电荷重心的电量(q)有关.一般用偶极距(μ)来衡量.分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积.即μ=d·q.试回答以下问题: (1)HCl.CS2.H2S.SO2四种分子中μ=0的是 . (2)对硝基氯苯.邻硝基氯苯.间硝基氯苯.三种分子的偶极矩由大到小的排列顺序是 . (3)实验测得:μ(PF3)=1.03德拜,μ(BCl3)=0.由此可知.PF3分子是 构型.BCl3分子是 构型. (4)冶癌药Pt(NH3)2Cl2具有平面四边形结构.Pt处在四边形中心.NH3和Cl分别处在四边形的4个角上.已知该化合物有两种异构体.棕黄色者μ>0.淡黄色者μ=0.试画出两种异形体的构型图.并比较在水中的溶解度. ①构型图:淡黄色 .棕黄色 .这两种化合物互为 . ②棕黄色固体在水中溶解度较大的原因是 . [参考答案] 1.D 2.B 3.D 4.D 5.D 6.B 7.B 8.B 9.A 10.B 11.C 12.B 13.A 14.A 15.D 16.B 17.AC 18.①金的原子中存在原子核.它占原子中极小的体积. ②金的原子核带正电荷.且电荷数远远大于α粒子. ③金的原子核质量远远大于α粒子. 19.2H2O=H3O++OH- (3)H2O.H2O中含氢键 (4)分子晶体,极性分子 20.(1)NH4+.H3O+.NH2-.OH- (2)H2S.PH3.SiH4.HCl (3)NH4+.SiH4,NH3 21.(1)F,Li,随原子序数的增加.第一电离能逐渐增大,同一周期.从左向右.元素的非金属性增强.金属性减弱. (2)Be.N的核外电子排布为全充满.半充满状态.故Be.N比较稳定.失电子需吸收的能量多. 22.(1)MgO的熔点比MgCl2高.AlCl3的熔点低.易升华.属于分子晶体.熔融时不导电. (2)将两种晶体加热到熔化状态.MgCl2能导电而AlCl3不导电.故可证明MgCl2为离子晶体.AlCl3为分子晶体. 23.(1)CS2. 三角锥形,平面三角形. (4)①,同分异构体. ②因为分子结构不对称.分子有极性.因而在水中溶解度较大.
网址:http://m.1010jiajiao.com/timu3_id_58175[举报]
(16分)胆矾是一种重要工业用盐,如电镀工业用作全光亮酸性镀铜主盐和铜离子添加剂。印染工业用作媒染剂和精染布的助氧剂。农业上作为杀菌剂。某研究小组拟用废旧铜器(主要杂质为含铁的化合物)来制备胆矾。设计流程如下:
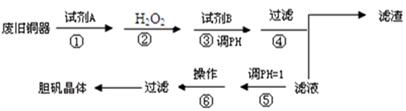
pH值控制可参考下列数据
请根据上述流程回答下列问题:
(1)试剂A可选用_____(填字母)。
a.稀H2SO4 b.浓H2SO4 c.浓FeCl3溶液 d.浓HNO3
(2)第②步加入H2O2溶液发生的反应的离子方程式为:_____________________________。
(3)第③步中所加试剂B为________(填化学式)。调节溶液的pH合适的范围是__________。
(4)操作⑤通常加H2SO4调节pH=1是为了:______________________________________。
(5)本流程中多次用到过滤操作,该操作主要用到的玻璃仪器为: _______________,操作⑥的主要步骤为: 、 。
(6)某同学认为上述流程中所加的试剂A并不理想,需作改进,其理由是______________
__________________________________________________________。请你帮助提出一条改进方案____________ 。

pH值控制可参考下列数据
| 物质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
(1)试剂A可选用_____(填字母)。
a.稀H2SO4 b.浓H2SO4 c.浓FeCl3溶液 d.浓HNO3
(2)第②步加入H2O2溶液发生的反应的离子方程式为:_____________________________。
(3)第③步中所加试剂B为________(填化学式)。调节溶液的pH合适的范围是__________。
(4)操作⑤通常加H2SO4调节pH=1是为了:______________________________________。
(5)本流程中多次用到过滤操作,该操作主要用到的玻璃仪器为: _______________,操作⑥的主要步骤为: 、 。
(6)某同学认为上述流程中所加的试剂A并不理想,需作改进,其理由是______________
__________________________________________________________。请你帮助提出一条改进方案____________ 。
已知有关物质的熔、沸点数据如下表:

工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3和冰晶石(Na3AlF6)熔融混合物的方法生产金属铝,请参考上述数据回答下列问题:
(1)为什么不用电解MgO的方法生产镁?理由是
___________________________________________。
(2)为什么不用电解AlCl3的方法生产铝?理由是___________________________________________。 查看习题详情和答案>>

工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3和冰晶石(Na3AlF6)熔融混合物的方法生产金属铝,请参考上述数据回答下列问题:
(1)为什么不用电解MgO的方法生产镁?理由是
___________________________________________。
(2)为什么不用电解AlCl3的方法生产铝?理由是___________________________________________。 查看习题详情和答案>>
已知有关物质的熔、沸点数据如下表:

请参考上述数据回答下列问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝.为什么不用电解MgO的方法生产镁;也不用电解AlCl3的方法生产铝?
答________.
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是________.

 (2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是__ _____。
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是__ _____。
 (2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是__ _____。
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是__ _____。