摘要: (1)①2Na2O2+2H2O 4Na++4OH-+O2↑ ②2A1+2OH-+6H2O 2[A1(OH)4]-+3H2↑ (2)听到尖锐的暴鸣声 2010年高考化学第二轮复习20分钟专题突破(11) 专题 铁与铁的化合物
网址:http://m.1010jiajiao.com/timu3_id_57632[举报]
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答:
(1)元素C在周期表中的位置是
(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式
(3)D和E两种元素相比较,其原子得电子能力较强的是
以下说法中,可以证明上述结论的是
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是:
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y.在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X
(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为
查看习题详情和答案>>
(1)元素C在周期表中的位置是
第二周期第ⅣA族
第二周期第ⅣA族
.(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式
2Na2O2 +2H2 O=4Na++4OH-+O2↑
2Na2O2 +2H2 O=4Na++4OH-+O2↑
.(3)D和E两种元素相比较,其原子得电子能力较强的是
氧
氧
(写名称).以下说法中,可以证明上述结论的是
bc
bc
(填写编号).a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是:
HSO3-+H+=SO2↑+H2O
HSO3-+H+=SO2↑+H2O
.(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y.在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X
>
>
Y(填“>”、“=”或“<”)(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为
12
12
.水是组成生命体的重要化学物质,没有水就没有生命.2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心,再一次警示人们关注水资源.阅读下列有关水的问题并正确作答.
(1).水分子自身作用生成含有相同电子数的阴、阳两种离子,写出此过程的方程式
(2)25℃时,在由水电离产生的c(H+)=1×10-14 mol?L-1的溶液中,①NH4+、Al3+、Br-、SO42- ②Na+、Mg2+、Cl-、NO3-③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定可以大量共存的是
(3)在下列反应中,水仅做氧化剂的是
A.Cl2+H2O=HCl+HClO B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑ D.3Fe+4H2O(g)
Fe3O4+4H2.
查看习题详情和答案>>
(1).水分子自身作用生成含有相同电子数的阴、阳两种离子,写出此过程的方程式
2H2O H3O++OH-
H3O++OH-
 H3O++OH-
H3O++OH-2H2O H3O++OH-
H3O++OH-
. H3O++OH-
H3O++OH-(2)25℃时,在由水电离产生的c(H+)=1×10-14 mol?L-1的溶液中,①NH4+、Al3+、Br-、SO42- ②Na+、Mg2+、Cl-、NO3-③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定可以大量共存的是
③
③
(填序号,下同),可能大量共存的是①②
①②
,一定不能大量共存的是④
④
.(3)在下列反应中,水仅做氧化剂的是
CD
CD
(填字母,下同),水既不做氧化剂又不做还原剂的是AB
AB
.A.Cl2+H2O=HCl+HClO B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑ D.3Fe+4H2O(g)
| ||
氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
Fe3O4+4H2
⑤2H2O
2H2↑+O2↑
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是
(2)在这些氧化还原反应中,水只作氧化剂的反应是
水只作还原剂的反应是
水既不作氧化剂,又不作还原剂是
(3)根据你的理解,氧化还原反应的实质是
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?
(Ⅱ)写出下列反应的离子方程式:
①往氯化铁溶液加入铁粉:
②过量二氧化碳通入澄清石灰水:
③往氯化铝溶液中加入足量的NaOH溶液:
(Ⅲ)写出下列反应的化学方程式:
①二氧化硫发生催化氧化反应:
②氯气与氢氧化钠溶液反应:
③铜片与稀硝酸的反应:
查看习题详情和答案>>
(Ⅰ)下列一组有水参与的反应:
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
| ||
⑤2H2O
| ||
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是
③
③
(填编号)(2)在这些氧化还原反应中,水只作氧化剂的反应是
①④
①④
(填编号)水只作还原剂的反应是
⑥
⑥
(填编号)水既作氧化剂,又作还原剂是⑤
⑤
(填编号)水既不作氧化剂,又不作还原剂是
③
③
(填编号)(3)根据你的理解,氧化还原反应的实质是
C
C
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?
是
是
(填“是”或“不是”),若是,这个反应的氧化剂是NO2
NO2
,还原剂是NO2
NO2
.(Ⅱ)写出下列反应的离子方程式:
①往氯化铁溶液加入铁粉:
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
②过量二氧化碳通入澄清石灰水:
CO2+OH-=HCO3-
CO2+OH-=HCO3-
③往氯化铝溶液中加入足量的NaOH溶液:
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
(Ⅲ)写出下列反应的化学方程式:
①二氧化硫发生催化氧化反应:
2SO2+O2
2SO3
| ||
| 高温高压 |
2SO2+O2
2SO3
| ||
| 高温高压 |
②氯气与氢氧化钠溶液反应:
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
③铜片与稀硝酸的反应:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
.I.工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g).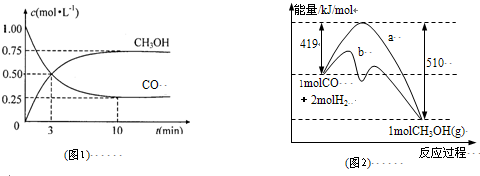
(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
(2)图2表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.该反应是
(3)该反应平衡常数K的表达式为
(4)恒容条件下,下列措施中能使
增大的有
a.升高温度; b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂
II.(13分)某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置.A中所用试剂从下列固体物质中选取:a.NH4HCO3、b.NH4Cl、c.Ca(OH)2、d.NaOH.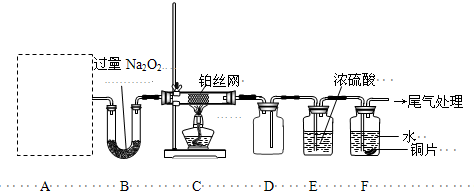
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯.部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解.
(1)实验室制取A中气体时若只用一种试剂,该试剂是
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:
(3)对于C中发生的可逆反应,下列说法正确的是
a.增大一种反应物的浓度可以提高另一种反应物的转化率
b.工业上进行该反应时,可采取高压的条件提高反应物转化率
c.该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
(4)请在图坐标中画出C装置中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式.
(5)待实验结束后,将B中固体混合物溶于500mL1mol?L-1 盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是
查看习题详情和答案>>

(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
0.075mol?L-1?min-1
0.075mol?L-1?min-1
;(2)图2表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.该反应是
放热
放热
(选填“吸热”或“放热”)反应,写出反应的热化学方程式CO(g)+2H2(g)═CH3OH(g)△H=-91KJ/mol
CO(g)+2H2(g)═CH3OH(g)△H=-91KJ/mol
;选择适宜的催化剂,不能
不能
(填“能”或“不能”)改变该反应的反应热;(3)该反应平衡常数K的表达式为
K=
| c(CH3OH) |
| c(CO)×c2(H2) |
K=
,温度升高,平衡常数K| c(CH3OH) |
| c(CO)×c2(H2) |
减小
减小
(填“增大”、“不变”或“减小”);(4)恒容条件下,下列措施中能使
| n(CH3OH) |
| n(CO) |
c
c
.a.升高温度; b.充入He气 c.再充入1molCO和2molH2 d.使用催化剂
II.(13分)某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置.A中所用试剂从下列固体物质中选取:a.NH4HCO3、b.NH4Cl、c.Ca(OH)2、d.NaOH.

检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯.部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解.
(1)实验室制取A中气体时若只用一种试剂,该试剂是
a
a
(填备选试剂的字母);此时A中主要的玻璃仪器有试管、酒精灯(导管)
试管、酒精灯(导管)
(填名称).(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:
2Na2O2+2H2O=4NaOH+O2↑或2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2H2O=4NaOH+O2↑或2Na2O2+2CO2=2Na2CO3+O2
.(3)对于C中发生的可逆反应,下列说法正确的是
a
a
.a.增大一种反应物的浓度可以提高另一种反应物的转化率
b.工业上进行该反应时,可采取高压的条件提高反应物转化率

c.该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
(4)请在图坐标中画出C装置中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式.
(5)待实验结束后,将B中固体混合物溶于500mL1mol?L-1 盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是
0.25
0.25
mol,甲在标准状况下是2.8
2.8
L(忽略气体的溶解).