网址:http://m.1010jiajiao.com/timu3_id_57530[举报]
[化学——选修物质结构与性质]
原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,![]() 比
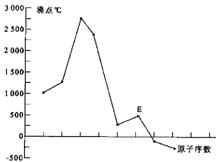
比![]() 少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的
少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的
 甲、乙两种分子,且两种
甲、乙两种分子,且两种
分子中各原子的个数见下表:
| 化合物 | 甲 | 乙 |
| 原子个数比 | B:A=1:4 | C:A=1:3 |
(1)元素F的基态原子的电子排布式为 。
(2)分子甲的空间构型为 ,该分子中B的
原子轨道发生的是 杂化。
(3)E单质属于 晶体,E与A元素形成 分子(填“极性”或“非极性”)
(4)D在F中燃烧的产物属于 晶体,其晶体中与![]() 最近且等距离的
最近且等距离的![]() 有 个。
有 个。
(5)C元素的第一电离能(![]() ) 氧元素的第一电离能(
) 氧元素的第一电离能(![]() )(填“<”或“>”或“=”)。
)(填“<”或“>”或“=”)。
A,B,C,D四种短周期元素的原子序数依次增大.A,D同族;B,C同周期.A,B组成的化合物甲为气态;其中A,B原子个数之比为4∶1.常温下,由A,C组成的两种化合物乙和丙都为液态;乙中A,C原子个数比为1∶1;丙中A,C原子个数比为2∶1.由于D和C组成的两种化合物丁和戊都为固态;丁中D,C原子个数之比为1∶1;戊中D,C原子个数比为2∶1.B元素的最高价氧化物跟丁能发生化学反应,生成物为两种,其中一种为C的单质.
(1)各物质的化学式分别为:甲________、乙________、丙________、丁________、戊________.
(2)B元素的最高价氧化物跟丁反应的化学方程式为______________________.
查看习题详情和答案>>(1)试比较D、E两元素的最高价氧化物对应的水化物的酸性强弱(填化学式):
(2)A和B可形成原子个数比为1:1的化合物,其化学式为
(3)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的化学方程式
(4)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应且生成气体的化学方程式
(1)D在元素周期表中的位置是
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为


(3)D与C形成的化合物可与Y反应生成单质Z,该反应的化学方程式为
(4)写出实验室制备BA3的化学方程式
| ||
| ||
(5)已知B2A4可燃烧生成B的单质和Y,以B2A4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池负极反应是
回答下列问题:
(1)C与D形成的化合物的化学式是
 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH- Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-(2)将X气体通入A与F形成的化合物的水溶液中,使之恰好完全反应.此时溶液呈
(3)F的单质在反应中常作
(4)写出X分子的等电子体(原子数和电子数均相等的粒子)

