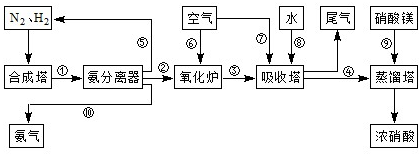
摘要: 工业合成氨与制备硝酸一般可连续生产.流程如下: 在800℃.铂催化剂存在条件下.氨与氧气反应的主要产物是NO和H20.在实际生产中氨的氧化率与混合气中氧氨比(氧气与氨气物质的量比.以γ{n(02)/n(NH3)}表示)的关系如下图 (1)氨氧化率达到100%.理论上γ{n(02)/n(NH3)}为1.25.而实际生产要将丫值维持在1.7~2.2之间.其原因是 . (2)若使氨的氧化率达到95%.应控制氨在氨.空气混合气体中的体积分数约为 (设氧气占空气的体积分数为20%).将γ=1.75的氨.空气混合气体通入800℃.盛有铂催化剂的氧化炉.充分反应后导入到吸收塔的气体的主要成分是 . (3)现以a mol NH3和足量空气为原料(不考虑N2的反应)最大程度制取NH4N03.经过一系列转化反应后.向反应后的混合物中加入b g水.得到密度为ρg·mL-1的溶液.计算该溶液中NH4N03物质的量浓度可能的最大值
网址:http://m.1010jiajiao.com/timu3_id_57438[举报]
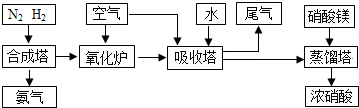
工业合成氨与制备硝酸一般可连续生产,流程如下
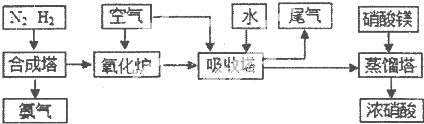
(1)①工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2,850℃时,往1L密闭容器中充入0.3mol CO和0.2molH2O(g).反应4min后建立平衡,体系中c(H2)=0.12mol?L-1.CO的平衡浓度为
②在850℃时,以表中的物质的量投入恒容反应器中,其中向逆反应方向进行的有
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1
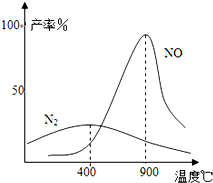
(3)N2和H2在铁作催化剂作用下从145℃就开始反应,不同温度下NH3产率图1所示.温度高于900℃时,NH3产率下降,原因是
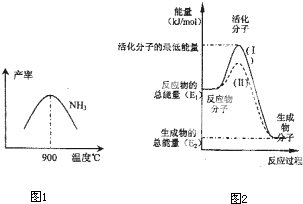
(4)在化学反应中只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图2,回答问题.
图中所示反应是
O2(g)=H2O(g)△H=-241.8kJ?mol-1,该反应的活化能为167.2kJ?mol-1,则其逆反应的活化能为
(5)硝酸厂的尾气直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
查看习题详情和答案>>

(1)①工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2,850℃时,往1L密闭容器中充入0.3mol CO和0.2molH2O(g).反应4min后建立平衡,体系中c(H2)=0.12mol?L-1.CO的平衡浓度为
0.18mol/L
0.18mol/L
转化率为40%
40%
该温度下此反应的平衡常数K=1
1
(填计算结果).②在850℃时,以表中的物质的量投入恒容反应器中,其中向逆反应方向进行的有
A
A
(选填A、B、C、D、E)| A | B | C | D | E | |
| n(CO2) | 3 | l | 0 | 1 | l |
| n(H2) | 2 | l | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | l |
<
<
300℃(填“>”、“<”或“=”).| T/°C | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
900℃时反应达到平衡状态,再升高温度平衡向左移动
900℃时反应达到平衡状态,再升高温度平衡向左移动
.
(4)在化学反应中只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图2,回答问题.
图中所示反应是
放热
放热
(填“吸热”或“放热”)反应,该反应的△H=-(E1-E2)kJ/mol
-(E1-E2)kJ/mol
(用含E1、E2E的代数式表示).已知热化学方程式:H2(g)+| 1 |
| 2 |
409kJ/mol
409kJ/mol
.(5)硝酸厂的尾气直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ?mol-1
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ?mol-1
.工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)在合成氨的反应中,改变反应条件,会使平衡发生移动.如图象表示随条件改变,氨气的百分含量的变化趋势.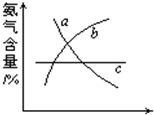
当横坐标为压强时,变化趋势正确的是(选填字母序号)
当横坐标为温度时,变化趋势正确的是(选填字母序号)
(2)如图所示三个容积相同的容器①、②、③,若起始温度相同,分别向三个容器中充入3mol H2和1mol N2,一定条件下反应,达到平衡时各容器中NH3物质的百分含量由大到小的顺序为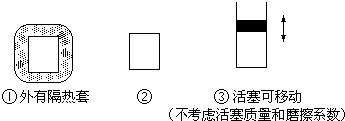
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图所示):
4NH3+5O2?4NO+6H2O
4NH3+3O2?2N2+6H2O
温度较低时以生成
查看习题详情和答案>>

(1)在合成氨的反应中,改变反应条件,会使平衡发生移动.如图象表示随条件改变,氨气的百分含量的变化趋势.

当横坐标为压强时,变化趋势正确的是(选填字母序号)
b
b
,当横坐标为温度时,变化趋势正确的是(选填字母序号)
a
a
.(2)如图所示三个容积相同的容器①、②、③,若起始温度相同,分别向三个容器中充入3mol H2和1mol N2,一定条件下反应,达到平衡时各容器中NH3物质的百分含量由大到小的顺序为
①<②<③
①<②<③
(填容器编号)
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图所示):
4NH3+5O2?4NO+6H2O
4NH3+3O2?2N2+6H2O
温度较低时以生成
N2
N2
为主,温度高于900℃时,NO产率下降的原因生成NO的反应为放热反应,升高温度转化率下降
生成NO的反应为放热反应,升高温度转化率下降
.吸收塔中需要补充空气的原因进一步与NO反应生成硝酸
进一步与NO反应生成硝酸
.
工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.该温度下此反应的平衡常数K=
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的转化率α(H2O)=
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g);△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中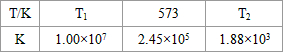
T1
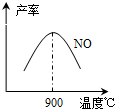 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
(4)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去.
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收.当处理后的废水中c(Ca2+)=2×10-7 mol/L时,溶液中c(PO43-)=
(已知Ksp[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石-鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓.该方法中需要控制污水的pH为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为
查看习题详情和答案>>

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.该温度下此反应的平衡常数K=
1
1
(填计算结果).②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的转化率α(H2O)=
50%
50%
.(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g);△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中

T1
<
<
573K(填“>”、“<”或“=”). (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因温度高于900℃时,平衡向左移动
温度高于900℃时,平衡向左移动
.(4)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去.
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收.当处理后的废水中c(Ca2+)=2×10-7 mol/L时,溶液中c(PO43-)=
5×10-7
5×10-7
mol/L.(已知Ksp[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石-鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓.该方法中需要控制污水的pH为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为
当pH高于10.7时,溶液中的Mg2+、NH4+会与OH-反应,平衡向逆反应方向移动
当pH高于10.7时,溶液中的Mg2+、NH4+会与OH-反应,平衡向逆反应方向移动
.与方法一相比,方法二的优点为能同时除去废水中的氮,充分利用了镁矿工业废水
能同时除去废水中的氮,充分利用了镁矿工业废水
.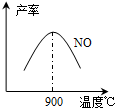 工业合成氨与制备硝酸一般可连续生产,流程如下:
工业合成氨与制备硝酸一般可连续生产,流程如下: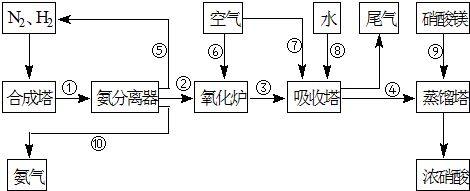
(1)合成塔中发生反应:N2(g)+3H2(g)?2NH3(g)+Q(Q>0).下表为不同温度下该反应的平衡常数.
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(2)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)+905kJ,不同温度下NO气体的产率如图所示.温度高于900℃时,NO气体产率下降的原因是
(3)吸收塔中反应为:3NO2+H2O?2HNO3+NO.从生产流程看,吸收塔中需要补充空气,其原因是
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)→4NO(g)+CO2(g)+2H2O(g)+574kJ;
CH4(g)+4NO(g)→2N2(g)+CO2(g)+2H2O(g)+1160kJ.
则1mol甲烷直接将NO2还原为N2的热化学方程式为:
工业合成氨与制备硝酸一般可连续生产,流程如图:
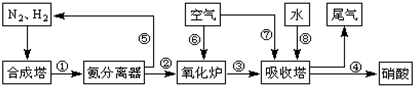
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)?CO2(g)+H2(g).t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.则该温度下此反应的平衡常数K= (填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1 300℃(填“>”、“<”或“=”).
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 .
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 .
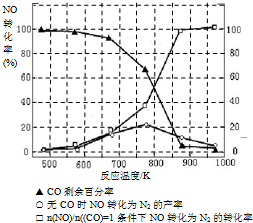
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如下图.据图分析,若不使用CO,温度超过775℃,发现NO的转化率降低,其可能的原因为 ;在
=1的条件下,应控制的最佳温度在 左右.
 查看习题详情和答案>>
查看习题详情和答案>>

(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)?CO2(g)+H2(g).t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.则该温度下此反应的平衡常数K=
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g)△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气.目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如下图.据图分析,若不使用CO,温度超过775℃,发现NO的转化率降低,其可能的原因为
| n(NO) |
| n(CO) |
 查看习题详情和答案>>
查看习题详情和答案>>