网址:http://m.1010jiajiao.com/timu3_id_57274[举报]
 运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义.请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ?mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ?mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=
(2)硫酸生产中涉及反应:2SO2(g)+O2(g)?2SO3(g).
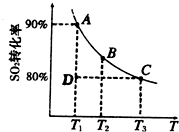
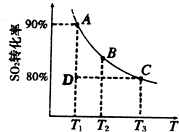
①一定条件下,的平衡转化率和温度的关系如右图所示.该反应的△H
②某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol?L-1,则0~10min内的平均反应速率v(SO2)=
③下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化?
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化?
④以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是
A.向容器中通入少量O2 B.向容器中通入少量SO2?C.使用催化剂 D.升高温度?E.恒容通入少量氦气?
⑤气体SO2是大气污染物,可选用下列试剂中的
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨.
请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ?mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ?mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H=______.
(2)硫酸生产中涉及反应:2SO2(g)+O2(g)?2SO3(g).
①一定条件下,的平衡转化率和温度的关系如右图所示.该反应的△H______O(填“>”或“<”).反应进行到状态D时,v正______v逆(填“>”、“<”或“=”).?
②某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol?L-1,则0~10min内的平均反应速率v(SO2)=______,该温度下反应的平衡常数K=______.
③下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)______
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化?
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化?
④以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是______?
A.向容器中通入少量O2 B.向容器中通入少量SO2?C.使用催化剂 D.升高温度?E.恒容通入少量氦气?
⑤气体SO2是大气污染物,可选用下列试剂中的______吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨.
请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g)△H=-768.2KJ?mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0KJ?mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的△H= .
(2)硫酸生产中涉及反应:2SO2(g)+O2(g)?2SO3(g).
①一定条件下,的平衡转化率和温度的关系如右图所示.该反应的△H O(填“>”或“<”).反应进行到状态D时,v正 v逆(填“>”、“<”或“=”).?
②某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol?L-1,则0~10min内的平均反应速率v(SO2)= ,该温度下反应的平衡常数K= .
③下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化?
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化?
④以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是 ?
A.向容器中通入少量O2 B.向容器中通入少量SO2?C.使用催化剂 D.升高温度?E.恒容通入少量氦气?
⑤气体SO2是大气污染物,可选用下列试剂中的 吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨.
 查看习题详情和答案>>
查看习题详情和答案>>
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s)
△H=-272 kJ·mol-1
FeO(s)
△H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中
FeO(s)+CO(g) Fe(s)+CO2(g) △H=
。
Fe(s)+CO2(g) △H=
。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。
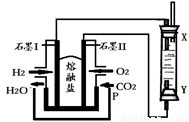
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作为电解液
C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH-
D.白色沉淀只能在阳极上产生
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为 ,该反应的化学方程式为 。
查看习题详情和答案>>
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g)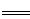 FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。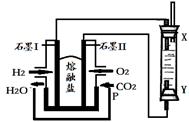
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |