摘要:(1)2NxHy+y/2 O2 =xN2 + yH2O (2)x=2,y=4 讲析:依题意气体由反应前的7 mL变为反应后的10 mL.根据化学方程式.利用差量法求得不定方程 x+y/2 =4 然后讨论.①当x=1, y=6 ②当x=2, y=4 ③当x=3, y=2
网址:http://m.1010jiajiao.com/timu3_id_57080[举报]
(2011?新余二模)Mg及其化合物可以发生如下转化(部分反应物、生成物或水已略去),已知X、Y、Z为气态单质,B常温下为液态,D为化合物,它的焰色反应为黄色,C和G混合冒白烟并生成A

(1)写出下列物质的化学式:A
(2)写出C的电子式

(3)写出MgCl2与D反应的化学方程式
(4)请用电离或水解平衡解释A+B+Mg→C+X+MgCl2的原因
(5)将1molCO2通入1L溶质为F的溶液中,充分反应后,再向混合液中逐滴滴加盐酸,所加盐酸的体积与生成的气体的关系如图所示则原F溶液的浓度为
查看习题详情和答案>>

(1)写出下列物质的化学式:A
NH4Cl
NH4Cl
YO2
O2

(2)写出C的电子式


(3)写出MgCl2与D反应的化学方程式
2MgCl2+2Na2O2+2H2O=4NaCl+2Mg(OH)2↓+O2↑
2MgCl2+2Na2O2+2H2O=4NaCl+2Mg(OH)2↓+O2↑
(4)请用电离或水解平衡解释A+B+Mg→C+X+MgCl2的原因
NH4Cl水解生成NH3?H2O和HCl,加入镁后,因为镁非常活泼,与水解所得盐酸反应生成H2,使溶液中氢离子的浓度减小,从而促进了NH4Cl的水解,最终逸出NH3.
NH4Cl水解生成NH3?H2O和HCl,加入镁后,因为镁非常活泼,与水解所得盐酸反应生成H2,使溶液中氢离子的浓度减小,从而促进了NH4Cl的水解,最终逸出NH3.
.(5)将1molCO2通入1L溶质为F的溶液中,充分反应后,再向混合液中逐滴滴加盐酸,所加盐酸的体积与生成的气体的关系如图所示则原F溶液的浓度为
3mol/L
3mol/L
mol/L. (2011?漳州一模)某短周期主族元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
(2011?漳州一模)某短周期主族元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:甲+乙
| △ |
(1)若丙为NO2.
①甲与乙反应的化学方程式为
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
②NO2可作火箭重要燃料-肼(N2H4)的助燃剂.已知:
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1,
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ?mol-1.
写出燃料-肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ?mol-1
.(2)若丙为SO2.
①把乙滴入硫酸铜晶体,观察到的现象是
蓝色晶体变白色
蓝色晶体变白色
.②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式:
 MnO4-+
MnO4-+ SO2+
SO2+
2H2O
2H2O
= Mn2++
Mn2++ SO42-+
SO42-+ H+
H+③SO2在一定条件下,发生:2SO2(g)+O2(g)?2SO3(g)△H<0反应.
该反应的化学平衡常数K=
| c2(SO3) |
| c2(SO2)c(O2) |
| c2(SO3) |
| c2(SO2)c(O2) |
c
c
(填序号).a.x表示温度,y表示SO2的物质的量
b.x表示压强,y表示SO2的转化率
c.x表示SO2的物质的量,y表示O2的物质的量
d.x表示SO3的物质的量,y表示化学平衡常数K.
(2012?绵阳模拟)在500°C、常压下,将2mol SO2和1mol02放入一个体积可变的密闭容器中,测得容器的起始容积为200L.经一段时间后反应达到平衡,混合气体的体积变为140L,请回答下列问题:
(1)SO2的转化率为
(2)若起始时加入amolSO2、b mol O2,且a:b=2:l,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为210L.则 a=
(3)若将密闭容器体积固定为200L,起始时加入xmolSO2、y mol O2和z mol SO3,反应达平衡时,温度、压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,则x、y应该满足的关系式为
查看习题详情和答案>>
(1)SO2的转化率为
90%
90%
.如果向平衡混合气中充入N 2,SO2的转化率如何变化?降低(或减小)
降低(或减小)
.(2)若起始时加入amolSO2、b mol O2,且a:b=2:l,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为210L.则 a=
3
3
,容器的起始容积为300L
300L
SO3的体积分数为85.7%(或
)
| 6 |
| 7 |
85.7%(或
)
| 6 |
| 7 |
(3)若将密闭容器体积固定为200L,起始时加入xmolSO2、y mol O2和z mol SO3,反应达平衡时,温度、压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,则x、y应该满足的关系式为
x=2y
x=2y
,x、z应该满足的关系式为x+z=
| 20 |
| 7 |
x+z=
.| 20 |
| 7 |
有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答: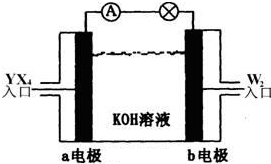
(1)Z2的电子式为
 ,Y的原子结构示意图为
,Y的原子结构示意图为
 ,YW2的结构式为
,YW2的结构式为
(2)将YX4、W2按上图所示通入某燃料电池中,则两极的电极方程式分别为:
a电极:
(3)已知在120℃、101kPa下,0.5mol X2在W2中完全燃烧时,释放出120.9kJ的热量,该反应的热化学方程式为
(4)Y和Z结合可生成一种超硬物质,本身耐磨损,抗腐蚀,则该物质属于
查看习题详情和答案>>

(1)Z2的电子式为




O=C=O
O=C=O
.(2)将YX4、W2按上图所示通入某燃料电池中,则两极的电极方程式分别为:
a电极:
CH4-8e-+10OH-=CO32-+7H2O
CH4-8e-+10OH-=CO32-+7H2O
,b电极:O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
.若有16gW2参加反应,转移的电子数是2NA或1.204×1024
2NA或1.204×1024
.(3)已知在120℃、101kPa下,0.5mol X2在W2中完全燃烧时,释放出120.9kJ的热量,该反应的热化学方程式为
H2(g)+1/2 O2(g)═H2O(g)△H=-241.8kJ?mol-1
H2(g)+1/2 O2(g)═H2O(g)△H=-241.8kJ?mol-1
.(4)Y和Z结合可生成一种超硬物质,本身耐磨损,抗腐蚀,则该物质属于
原子
原子
晶体,该晶体中各粒子均满足8电子稳定结构,则化学式为C3N4
C3N4
.已知B、C为常见的两种金属单质,E、I为常见的两种非金属单质,A为硫酸盐反应②为D的溶液与C在加热条件下的反应,P溶液和G溶液中具有相同的阳离子,请根据要求回答下列问题.

(1)B元素在周期表的位置:
(2)物质I的电子式:
 .
.
(3)Y转变为X的现象是:
(4)写出反应④的化学反应方程式:
(5)向沸水中加入H的饱和溶液,可得到红褐色溶液,其溶液所具有性质
A.具有丁达尔效应
B.处加直流电源阳极附近溶液颜色加深
C.加入盐酸溶液出现先沉淀后溶解的现象
D.能透过半透膜,不能透过滤纸
(6)向含1molG的溶液中加入1molNa2O2,所发生的离子反应方程式:
查看习题详情和答案>>

(1)B元素在周期表的位置:
第四周期第ⅤⅢ族
第四周期第ⅤⅢ族
,(2)物质I的电子式:


(3)Y转变为X的现象是:
白色絮状沉淀迅速变为灰绿色,最终转化为红褐色
白色絮状沉淀迅速变为灰绿色,最终转化为红褐色
.涉及的反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(4)写出反应④的化学反应方程式:
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
.物质F与HI水溶液的离子反应方程式 式:Fe3O4+2I-+8H+=I2+3Fe2++4H2O
Fe3O4+2I-+8H+=I2+3Fe2++4H2O
.(5)向沸水中加入H的饱和溶液,可得到红褐色溶液,其溶液所具有性质
AC
AC
.A.具有丁达尔效应
B.处加直流电源阳极附近溶液颜色加深
C.加入盐酸溶液出现先沉淀后溶解的现象
D.能透过半透膜,不能透过滤纸
(6)向含1molG的溶液中加入1molNa2O2,所发生的离子反应方程式:
4Fe 2++4Na2O2+6H2O═4Fe(OH)3↓+8Na++O2↑
4Fe 2++4Na2O2+6H2O═4Fe(OH)3↓+8Na++O2↑
.