网址:http://m.1010jiajiao.com/timu3_id_57078[举报]
(5分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
 (1) 比较下列两组物质的熔点高低(填“>”或“<”)
(1) 比较下列两组物质的熔点高低(填“>”或“<”)
SiC Si; SiCl4_________SiO2
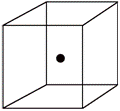
(2) 右图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3) 工业上用高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g); 该反应的反应热△H= kJ/mol
Si(s)+4HCl(g); 该反应的反应热△H= kJ/mol
碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。宇宙火箭和导弹中,大量用钛代替钢铁。
(1)Al的离子结构示意图为 ;
Al与NaOH溶液反应的离子方程式为
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,
其反应方程式为
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + x N2(g) + 6 H2(g)  Si3N4(s) + 12 HCl(g) △H<0
Si3N4(s) + 12 HCl(g) △H<0
在恒温、恒容时,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得HCl(g)为0.3mol/L、 N2为0.05 mol/L
① H2的平均反应速率是
② 反应前与达到平衡时容器内的压强之比=
③ 系数 x =
(4)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH1=+140 kJ·mol-1
C(s)+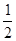 O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
。
碳化硅(SiC) 、氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。宇宙火箭和导弹中,大量用钛代替钢铁。
(1)Al的离子结构示意图为 ;
Al与NaOH溶液反应的离子方程式为
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,
其反应方程式为
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + x N2(g) + 6 H2(g)  Si3N4(s) + 12
HCl(g) △H<0
Si3N4(s) + 12
HCl(g) △H<0
在恒温、恒容时,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得HCl(g)为0.3mol/L、 N2为0.05 mol/L
① H2的平均反应速率是
② 反应前与达到平衡时容器内的压强之比=
③ 系数 x =
(4)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH1=+140 kJ·mol-1
C(s)+ O2(g)===
CO(g) ΔH2 =-110
kJ·mol-1
O2(g)===
CO(g) ΔH2 =-110
kJ·mol-1
写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
。
查看习题详情和答案>>
(1)Al的离子结构示意图为 ;
Al与NaOH溶液反应的离子方程式为
(2)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,
其反应方程式为
(3)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + x N2(g) + 6 H2(g)
 Si3N4(s) + 12 HCl(g) △H<0
Si3N4(s) + 12 HCl(g) △H<0 在恒温、恒容时,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2 L密闭容器内,进行上述反应,5 min达到平衡状态,所得HCl(g)为0.3mol/L、 N2为0.05 mol/L
① H2的平均反应速率是
② 反应前与达到平衡时容器内的压强之比=
③ 系数 x =
(4)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH1=+140 kJ·mol-1
C(s)+
 O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1
O2(g)=== CO(g) ΔH2 =-110 kJ·mol-1写出TiO2和焦炭、氯气反应生成TiCl4和CO气体的热化学方程式:
。