网址:http://m.1010jiajiao.com/timu3_id_56886[举报]
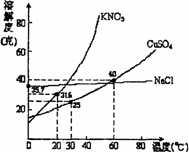
 右图是几种盐的溶解度曲线.下列说法正确的是( )
右图是几种盐的溶解度曲线.下列说法正确的是( )| A、40℃时,将35克食盐溶于100克水中,降温至0℃时,可析出氯化钠晶体 | B、20℃时,硝酸钾饱和溶液的质量百分比浓度是31.6% | C、60℃时,200克水中溶解80克硫酸铜达饱和.当降温至30℃时,可析出30克硫酸铜晶体 | D、30℃时,将35克硝酸钾和35克食盐同时溶于100克水中,蒸发时,先析出的是氯化钠 |
不同物质的溶解度会随温度的变化而发生不同的变化,利用这一性质,我们可以将物质进行分离和提纯。工业上制取
硝酸钾就是利用了该原理。请你回答以下问题:
1.右图是几种盐的溶解度曲线,下列说法正确是
(A)40℃时,将35克食盐溶于100克水中,降温至0℃时,可析 出氯化钠晶体
(B)20℃时,硝酸钾饱和溶液的质量百分比浓度是31.6%
(C)60℃时,200克水中溶解80克硫酸铜达饱和.当降温至30℃时,可析出30克硫酸铜晶体
(D)30℃时,将35克硝酸钾和35克食盐同时溶于100克水中, 蒸发时,先析出的是氯化钠
2.从右图曲线中可以分析得到KNO3和NaCl的溶解度随温度变化的关系是 。
3.请填写空白。
步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
① |
溶解 | 取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。 | NaNO3和KCl溶于水后产生四种离子,这四种离子可能组成四种物质 、 、 、 。这四种物质在不同温度下的溶解度特点 |
② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩。 | 有 晶体析出。 |
③ |
| 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为 。 |
④ | 冷却 | 将滤液冷却至室温。 | 有 晶体析出。尚有少量的 析出。 |
⑤ |
| 按有关要求进行操作 | 得到初产品硝酸钾晶体(称量为m1) |
⑥ |
| 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。 |
得到纯度较高的硝酸钾晶体(称量为m2) |
⑦ |
检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1d1mol/l的HNO3和2d0.1mol/l的AgNO3 | 可观察到⑤、⑥产品中出现的现象分别是
|
(1)检验所得产品中是否Cl-的目的是 。结合⑤、⑥步实验得到的产品质量,计算初产品的纯度为 。(不考虑损失)
(2)步骤③过滤使用了保温漏斗,用图所示装置,其主要作用是

(3)步骤③过滤装置如图1―8所示,采用这种装置过滤的主要目的是 
这种装置工作的主要原理是
(4)玻璃棒在实验中一般有如下三种用途:搅拌、引流和蘸取溶液,上述实验步骤中一般需要用到玻璃棒的是_______________(填代号).
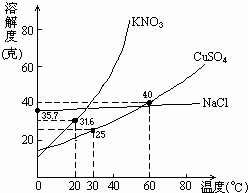
查看习题详情和答案>>右图是几种盐的溶解度曲线,下列说法正确是
 (A)40℃时,将35克食盐溶于100克水中,降温至0℃时,可析出氯化钠晶体
(A)40℃时,将35克食盐溶于100克水中,降温至0℃时,可析出氯化钠晶体
(B)20℃时,硝酸钾饱和溶液的质量百分比浓度是31.6%
(C)60℃时,200克水中溶解80克硫酸铜达饱和.当降温至30℃时,可析出30克硫酸铜晶体
(D)30℃时,将35克硝酸钾和35克食盐同时溶于100克水中, 蒸发时,先析出的是氯化钠
|
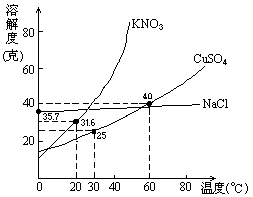
右图是几种盐的溶解度曲线,下列说法正确的是
| |
| [ ] | |
A. |
40℃时,将35克食盐溶于100克水中,降温至0℃时,可析出氯化钠晶体 |
B. |
20℃时,硝酸钾饱和溶液的质量分数是31.6% |
C. |
60℃时,200克水中溶解80克硫酸铜达饱和,当降温至30℃时,可析出30克硫酸铜晶体 |
D. |
30℃时,将35克硝酸钾和35克食盐同时溶于100克水中,蒸发时,先析出的是氯化钠 |
|
右图是几种盐的溶解度曲线.下列说法正确的是
| |
| [ ] | |
A. |
40℃时将35g食盐溶于100g水中,降温至0℃时,可析出氯化钠晶体. |
B. |
20℃时硝酸钾饱和溶液的质量分数为31.6%. |
C. |
60℃时,200g水中溶解度80g硫酸铜达饱和.当降温至30℃时,可析出30g酸铜晶体. |
D. |
30℃时将35g硝酸钾和35g食盐同时溶于100g水中,蒸发时先析出的是氯化钠. |