摘要:粒子可能是分子.原子和阴阳离子等.
网址:http://m.1010jiajiao.com/timu3_id_56831[举报]
微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有l0个电子;B溶于A后所得的物质可电离出D和E;C是重要的化石能源.将A、B和含F离子的物质混合后可得D和一种白色沉淀.G3+离子与Ar原子的电子层结构相同.请回答:
(1)基态G原子的外围电子排布式是 .在A、B、C这三种分子中,属于非极性分子的有 (写化学式).
(2)下列有关B的说法中正确的是 .(填字母)
a.在配合物中可作为配体
b.该分子的稳定性与氢键有关
c.分子中各原子最外层均为8e-的稳定结构
d.含1molB的液体中有3mol氢键
(3)根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型是 .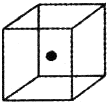
(4)构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,如图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子.
(5)光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中不存在 .(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g.σ键 h.π键.
查看习题详情和答案>>
(1)基态G原子的外围电子排布式是
(2)下列有关B的说法中正确的是
a.在配合物中可作为配体
b.该分子的稳定性与氢键有关
c.分子中各原子最外层均为8e-的稳定结构
d.含1molB的液体中有3mol氢键
(3)根据等电子体原理,D离子的空间构型是

(4)构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,如图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子.
(5)光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中不存在
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g.σ键 h.π键.
微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有10个电子;B溶
于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物质混
合后可得D和一种白色沉淀。![]() 离子与Ar原子的电子层结构相同。请回答:
离子与Ar原子的电子层结构相同。请回答:
(1)基态G原子的外围电子排布式是 。在A、B、C三种分子中,属于非极
性分子的有 (写化学式)。
(2)根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型
 是 。
是 。
(3)构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,
右图立方体中心的“![]() ”表示该晶体中的一个原子,请在该立方体的顶点上
”表示该晶体中的一个原子,请在该立方体的顶点上
用“![]() ”表示出与之紧邻的原子。
”表示出与之紧邻的原子。
(4)光谱证实F与烧碱溶液反应有![]() 生成,则
生成,则![]() 中不存在 (填字母)。
中不存在 (填字母)。
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g.![]() 键 h.
键 h.![]() 键
键
(1)把外层电子排布与氩原子的电子排布相同的两种阳离子和两种阴离子依其离子半径由小到大顺序排列为
(2)A+、B-、C、D四种微粒中均有氢原子,且电子总数均为10个.溶液中的A+和B-在加热时相互反应可转化为C和D.则A+的电子式为
 ,B-的电子式为
,B-的电子式为
 .
.
(3)4g D2和20g 18O2的单质化合时最多能生成
(4)在下列化合物中:H2O2、Na2O、I2、NaCl、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
①只由非金属组成的离子化合物是
②只有极性共价键的共价化合物是
③只含有非极性共价键的是
④既有离子键又有非极性键的化合物是
查看习题详情和答案>>
Ca2+<K+<Cl-<S2-
Ca2+<K+<Cl-<S2-
.这四种离子间形成离子化合物依其式量由小到大的顺序排列为CaS<KCl<K2S<CaCl2
CaS<KCl<K2S<CaCl2
.(2)A+、B-、C、D四种微粒中均有氢原子,且电子总数均为10个.溶液中的A+和B-在加热时相互反应可转化为C和D.则A+的电子式为




(3)4g D2和20g 18O2的单质化合时最多能生成
22
22
g D218O,这些D218O分子中含10
10
mol 质子,含12
12
mol中子,(4)在下列化合物中:H2O2、Na2O、I2、NaCl、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
①只由非金属组成的离子化合物是
NH4Cl
NH4Cl
,②只有极性共价键的共价化合物是
CO2
CO2
,③只含有非极性共价键的是
I2
I2
,④既有离子键又有非极性键的化合物是
Na2O2
Na2O2
.