网址:http://m.1010jiajiao.com/timu3_id_55906[举报]
A.《物质结构与性质》
(1)前三周期元素中第一电离能最小的是 _______ (填元素符号),其基态原子的电子排布式为 _______ 。第二周期非金属元素形成的氢化物中化学键极性最大的是 _______
(填分子式),该物质在CCl4中的溶解度比在水中的溶解度 _______ (填“大”或“小”)。
 |
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是 _______ (填物质字母代号)。
(3)晶格能的大小:MgO _______ NaCl,键能的大小:HBr _______ HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是 _______
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
B《实验化学》
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度 / ℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 _______ 。加热煮沸的主要目的是_ _______ 。
(2)沉淀B中除MnO2、SiO2外还含有 _______ (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 _______ ;
(4)沉淀C的化学式是 _______ 。过滤II需趁热过滤的理由是 _______
查看习题详情和答案>>纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示

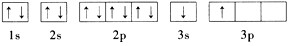
(2)ACl2分子中A的杂化类型为____________。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确________,并阐述理由_____________ 。
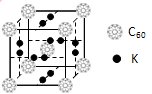
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式____________,该物质的K原子和C60分子的个数比为________________。
(16分)A、B、C是中学化学中常见的三种短周期元素。已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1) 写出A元素在周期表中的位置_______________________。
(2) 写出C的单质和强碱溶液反应的离子方程式____________________________________。
(3) 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的B4气态分子。B4分子结构与白磷分子结构相似,已知断裂1 mol B—B吸收167kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。
(4) 由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形
分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X的结构式为____________,X与水反应的化学方程式是___________________。
(5) A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为______________,Y晶体的熔点比金刚石熔点______(填“高”或“低”)。
(6) B2H4是一种可燃性液体,其水溶液呈弱碱性,是因为溶液中存在平衡:
H2B-BH2+H2O_________________________。
查看习题详情和答案>>
(16分)A、B、C是中学化学中常见的三种短周期元素。已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1) 写出A元素在周期表中的位置_______________________。
(2) 写出C的单质和强碱溶液反应的离子方程式____________________________________。
(3) 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的B4气态分子。B4分子结构与白磷分子结构相似,已知断裂1 mol B—B吸收167kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。
(4) 由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形
分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X的结构式为____________,X与水反应的化学方程式是___________________。
(5) A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为______________,Y晶体的熔点比金刚石熔点______(填“高”或“低”)。
(6) B2H4是一种可燃性液体,其水溶液呈弱碱性,是因为溶液中存在平衡:
H2B-BH2+H2O_________________________。
查看习题详情和答案>>
(16分)A、B、C是中学化学中常见的三种短周期元素。已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1) 写出A元素在周期表中的位置_______________________。
(2) 写出C的单质和强碱溶液反应的离子方程式____________________________________。
(3) 意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的B4气态分子。B4分子结构与白磷分子结构相似,已知断裂1 mol B—B吸收167kJ的热量,生成1 mol B≡B放出942 kJ热量。试写出由B4气态分子变成B2气态分子的热化学方程式:____________________________。
(4) 由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形
分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X的结构式为____________,X与水反应的化学方程式是___________________。
(5) A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为______________,Y晶体的熔点比金刚石熔点______(填“高”或“低”)。
(6) B2H4是一种可燃性液体,其水溶液呈弱碱性,是因为溶液中存在平衡:
H2B-BH2+H2O_________________________。
查看习题详情和答案>>