摘要:20.Ⅰ.操作麻烦.乙醇转化率低 Ⅱ.(1)使生成乙醇蒸气的速率加快 2CH3CH2OH+O2 2CH3CHO+2H2O ②控制甲中单位时间内的气泡数 带走过多热量.难以保证反应所需温度 反应放热太少.不能达到反应所需温度 冰水 解析:该实验目的是“乙醇的催化氧化并制取乙醛 .第一步是产生乙醇蒸汽.所以水浴加热的目的是产生足量的乙醇蒸汽.根据题中信息“铜丝能长时间保持红热直到实验结束 可知该反应是放热反应.该反应的一个关键是要保持适当温度使乙醇转化为较多的乙醛.因此要控制气体速率.因乙醛易溶于水.所以用水吸收要注意防倒吸,乙醛易挥发.若用直接冷却法.为保证冷却效果.可以用冰水降低温度.
网址:http://m.1010jiajiao.com/timu3_id_55603[举报]
Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次.
请你评价若用上述方法制取乙醛存在哪些不足(写出一点即可).
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管.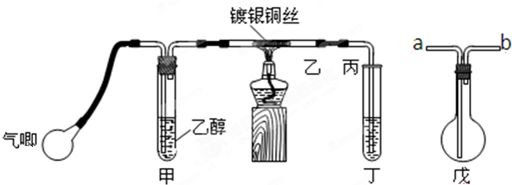
请填写下列空白:
(1)甲装置常常浸在70~80℃的水浴中,目的是
(2)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):
乙接
查看习题详情和答案>>
请你评价若用上述方法制取乙醛存在哪些不足(写出一点即可).
操作麻烦,乙醇转化率低
操作麻烦,乙醇转化率低
.Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管.

请填写下列空白:
(1)甲装置常常浸在70~80℃的水浴中,目的是
使生成乙醇蒸气的速率加快
使生成乙醇蒸气的速率加快
.(2)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):
乙接
b
b
、a
a
接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在冰水
冰水
中.合成氨反应为N2+3H2?2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相同)( )
查看习题详情和答案>>
(2011?沈阳二模)化学----化学与技术模块
海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:
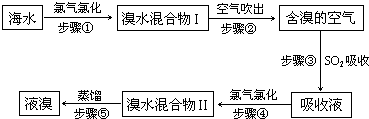
(1)步骤①反应的离子方程式是
(2)步骤③反应的化学方程式是
(3)Br的原子序数是
(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃.温度过高或过低都不利于生产,请解释原因:
(5)为什么不直接用“溴水混合物I”而要用“溴水混合物II”进行蒸馏,得到液溴?
查看习题详情和答案>>
海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:

(1)步骤①反应的离子方程式是
2Br-+Cl2=2Cl-+Br2
2Br-+Cl2=2Cl-+Br2
.(2)步骤③反应的化学方程式是
SO2+Br2+2H2O=2HBr+H2SO4
SO2+Br2+2H2O=2HBr+H2SO4
.(3)Br的原子序数是
35
35
,在周期表中位于4
4
周期ⅤⅡA
ⅤⅡA
族.(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃.温度过高或过低都不利于生产,请解释原因:
温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低
温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低
.(5)为什么不直接用“溴水混合物I”而要用“溴水混合物II”进行蒸馏,得到液溴?
溴水混合物I成分复杂,要获得溴需控制多个温度,操作麻烦
溴水混合物I成分复杂,要获得溴需控制多个温度,操作麻烦
.醇脱水反应在不同温度条件下得到的产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.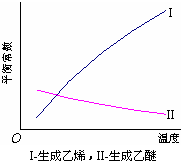
已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为78.4℃和34.5℃.试回答:
(1)乙醇脱水制乙烯的反应是 (填“放热”、“吸热”)反应,若在上述实验条件下,增大压强,平衡 (选填“正向”、“逆向”、“不”)移动;
(2)写出乙醇脱水制乙醚的反应的平衡常数表达式 .当乙醇起始浓度相同时,平衡常数K值越大,表明 (填序号);
A.乙醇的转化率越高 B.反应进行得越完全
C.达到平衡时乙醇的浓度越大 D.化学反应速率越快
(3)根据表中数据分析,为了又快又多地得到乙醚,反应的合适温度区域是 .选择该温度区域的理由是 .
查看习题详情和答案>>

| 温度 (℃) |
乙醇转化率 (%) |
有机产物含量 (体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 115 | 20 | 8.7 | 90.2 |
| 135 | 68 | 16.7 | 82.2 |
| 155 | 88 | 32.3 | 66.8 |
| 175 | 90 | 86.9 | 12.1 |
(1)乙醇脱水制乙烯的反应是
(2)写出乙醇脱水制乙醚的反应的平衡常数表达式
A.乙醇的转化率越高 B.反应进行得越完全
C.达到平衡时乙醇的浓度越大 D.化学反应速率越快
(3)根据表中数据分析,为了又快又多地得到乙醚,反应的合适温度区域是
空气中的SO2含量和可吸入颗粒的含量(可用g?cm-3表示)都是重要的空气质量指标.在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02mg?L-1.
(1)为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如图1所示的实验装置:
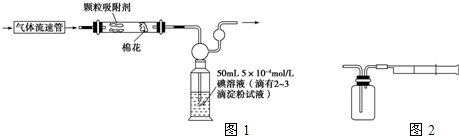
注:气体流速管是用来测量单位时间内通过气体的体积的装置
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3?min-1)外,还需要测定 .
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度.请你协助甲同学完成100mL 5×10-4mol?L-1碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, .
第二步: .
第三步:从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线.
(2)乙同学拟用如图1简易装置测定空气中的SO2含量:准确移取50mL 5×10-4 mol?L-1的碘溶液,注入如图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色.在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n).
①假设乙同学的测量是准确的,乙同学抽气的次数至少为 次,方可说明该地空气中的SO2含量符合排放标准.
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出两种合理假设: ; .
③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦.与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案: .
查看习题详情和答案>>
(1)为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如图1所示的实验装置:

注:气体流速管是用来测量单位时间内通过气体的体积的装置
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3?min-1)外,还需要测定
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度.请你协助甲同学完成100mL 5×10-4mol?L-1碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中,
第二步:
第三步:从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线.
(2)乙同学拟用如图1简易装置测定空气中的SO2含量:准确移取50mL 5×10-4 mol?L-1的碘溶液,注入如图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色.在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n).
①假设乙同学的测量是准确的,乙同学抽气的次数至少为
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出两种合理假设:
③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦.与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案: